Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными. Для того, чтобы правильно составлять реакции ионного обмена (полные ионные уравнения и сокращенные), необходимо разобраться в том, что такое электролиты.
Правило Бертолле
Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит.
Основные понятия и определения
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов).
Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Электролиты делят на сильные и слабые. К сильным электролитам относят вещества, которые хорошо диссоциируют, а к слабым – которые диссоциируют плохо. Вещества, которые не диссоциируют, называются неэлектролитами.
| Электролиты | Неэлектролиты | |
| Слабые электролиты | Сильные электролиты | |
| Слабые кислоты | Сильные кислоты | Оксиды, не взаимодействующие с водой |
| Нерастворимые основания и гидроксид аммония | Щелочи | Простые вещества |
| Растворимые и нерастворимые соли | Большинство органических соединений | |
Абсолютно нерастворимых веществ не бывает, небольшая часть молекул растворяется и диссоциирует, поэтому нерастворимые соли являются электролитами.
Сильные электролиты
Поскольку сильные электролиты диссоциируют хорошо, то в растворе они находятся почти полностью в виде ионов, поэтому в ионном уравнении мы должны расписать их в виде ионов. Рассмотрим, какие это вещества:
Все растворимые соли:
Расписываем их на катионы металла и анионы кислотного остатка (или комплексные ионы)
NaCl = Na+ + Cl—
K2SO4 = 2K+ + SO42-
K2HPO4 = 2K+ + HPO42- — если соль кислая, то ее кислотный остаток мы НЕ расписываем на ионы, а пишем так как есть (исключение HSO4— = H+ + SO42- — этот ион на ЕГЭ можно расписывать, а можно не расписывать).
K[Al(OH)4] = K+ + [Al(OH)4]— — комплексные ионы мы также не расписываем
Сильные кислоты:
Кислоты расписываем на катионы водорода и кислотные остатки
HCl = H+ + Cl—
H2SO4 = 2H+ + SO42-
Сильные основания:
Основания расписываем на катионы металла и гидроксид-анионы
KOH = K+ + OH—
Ca(OH)2 = Ca2+ + 2OH—
Слабые электролиты
Слабые электролиты плохо диссоциируют и поэтому находятся в растворе преимущественно в молекулярной форме (не в виде ионов). Из этого можно сделать вывод, что расписывать такие вещества на ионы НЕЛЬЗЯ. Также нельзя расписывать на ионы нерастворимые соли, хотя они и являются сильными электролитами, но они просто почти не растворяются, а поэтому и на ионы распасться не могут (но та малая часть, которая растворилась, будет находится в растворе в виде ионов).
Кого мы не расписываем на ионы:
1. Слабые кислоты: HF, H2SiO3, H3PO4
2. Слабые основания: Fe(OH)2, Cu(OH)2
3. Амфотерные гидроксиды: Al(OH)3, Zn(OH)2
4. Газы: СO2, SO2, NH3
5. Анионы кислых солей: HCO3—, HS—, HPO42-
6. Анионы комплексных солей: [Al(OH)4]—, [Zn(OH)4]2-
7. Осадки солей: BaSO4, AgCl
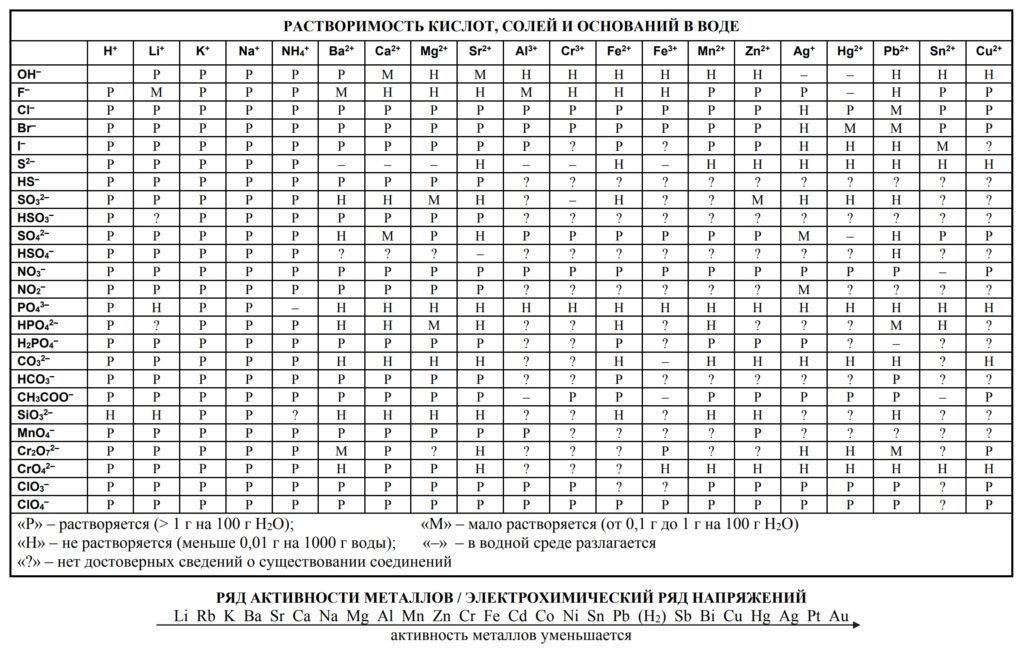
Нерастворимые и малорастворимые соединения обозначают буквами Н и М, если соль малорастворима, в продуктах её мы НЕ расписываем на ионы , однако гидроксиды являются сильными основаниями, их мы расписываем. В случае если малорастворимое вещество выступает в качестве реагента, мы его также расписываем на ионы.
Условия протекания реакций ионного обмена
В зависимости от того, кто вступает в реакцию ионного обмена, могут быть различные условия протекания реакции. Рассмотрим их:
1) кислота + основание = соль + вода
условие: сильное основание или растворимая нелетучая кислота
Кислоты, которые нам не подходят: H2CO3, H2SO3, H2SiO3
KOH + HNO3 = KNO3 + H2O
Cu(OH)2 + H2SO4 = CuSO4 + H2O
2) кислота + соль = другая кислота + другая соль
условие: образуется соль, нерастворимая в кислотах, или сильная кислота вытесняет более слабую из соли Соли не растворимые в кислотах:
а) нерастворимые соли с кислотным остатком SO42-(BaSO4, SrSO4, PbSO4)
б) нерастворимые соли с кислотным остатком S2-(CuS, Ag2S, Pb2S)
в) нерастворимые соль с кисл.остатком Cl—, Br—, I—(AgCl, AgBr, AgI)
Осадок соли: AgNO3 + HCl = AgCl↓ + HNO3
Осадок кислоты: Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
Выделение газа: Na2S + H2SO4 = Na2SO4 + H2S↑
3) соль + соль = другая соль + другая соль
условие: реагенты растворимы, в результате образуется осадок
CuSO4 + Na2S = CuS↓ + Na2SO4
AgNO3 + NaCl = AgCl↓ + NaNO3
4) соль + основание = другая соль + другое основание
условие: выделяется осадок, газ или слабый электролит
Выделение газа: NH4Cl + KOH = NH3↑ + H2O + KCl
Осадок соли: Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
Осадок гидроксида: Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3
Алгоритм составления РИО
1. Выбираем вещества в соответствии с условиями задания взаимодействия этих веществ, описанными выше
2. Проверяем степени окисления, в РИО они меняться не должны
3. Составляем ионные уравнения по схеме:
1) в виде ионов записывают сильные кислоты, щелочи и растворимые соли;
2) все остальные вещества оставляют в молекулярном виде, это осадки, газы и слабые электролиты;
3) правильное расставляем заряды ионов исходя из таблицы расвторимости;
4) одинаковые ионы сокращаем и получаем краткое ионное уравнение.
ZnF2 + 2HNO3 = Zn(NO3)2 + 2HF↑
Zn2+ + 2F— + 2H+ + 2NO3— = Zn2+ + 2NO3— + 2HF↑
2F— + 2H+ = 2HF↑ :2 (На экзамене писать не нужно!)
F— + H+ = HF↑




