В данном курсе мы рассмотрим основные типы химических реакций в органической химии. Их необходимо понимать и знать потому что на этих правилах основаны все взаимодействия в органической химии.
Реакции можно классифицировать по разным критериям. Например по механизму реакции, типу взаимодействия или изменению структуры.
Механизмы реакций— это последовательность этапов протекания химической реакции. На каждом этапе происходит создание или разрушение молекулярных связей.
В зависимости от способа разрыва связи различают реакции, протекающие по радикальному и ионному механизму. При радикальном механизме – промежуточными частицами в реакции являются радикалы, а при ионном механизме – промежуточными частицами в реакции являются ионы.
Радикальный механизм
В таких реакциях принимают участие свободные радикалы, образующиеся при гомолитическом разрыве молекулы. Радикалы имеют неспаренный электрон, за счет которого протекает реакция
Ионный механизм
Это процесс, в котором химические реакции протекают через образование и взаимодействие ионов
Типы реакций
1.Реакции замещения
— это реакция, в ходе которой 1 атом или группа атомов заменяется другой группой атомов в органическом веществе. Принцип схож с замещением в неорганической химии, однако механизм протекания реакции зависит от класса вещества.
Примеры:
1. Нуклеофильное замещение:
Реакция бромбензола с натриевым гидроксидом: реакция проходит через образование карбокатиона как промежуточного продукта. Это нуклеофильное замещение типа S_N1
+ NaOH ->
NaBr + H2O
Также возможно прямое взаимодействие нуклеофила с субстратом по типу замещения S_N2, что приводит к одновременному разрыву связи с функциональной группой. Примером является реакция бромистого метила с гидроксидом натрия
CH3Br + NaOH = CH3OH + NaBr
2. Электрофильное замещение:
Нитрование бензола
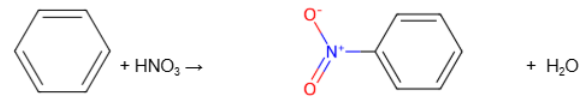
в бензоле происходит замещение водорода на нитрогруппу
3. Радикальное замещение
Галогенирование алканов:
CH4 + Cl2→CH 3 Cl + HCl один из атомов водорода в метане замещается на хлор
2.Реакции присоединения
— это реакции, в которых два или более реагента соединяются, образуя более сложное соединение.
1. Электрофильное присоединение
протекает по такому же механизму, как в замещении
Гидрирование соединений с кратной связью между атомами углерода:
C2H4 + H2 C2H6 этилен превращается в этан
2. Электрофильное присоединение
Гидратация соединений с кратной связью между атомами углерода:
C3H6 + H2O -> C3H8О пропен превращается в пропанол
3. Галогенирование соединений с кратной связью между атомами углерода:
— Присоединение брома к этилену- электрофильное присоединение. Бром выступает как электрофил, а двойная связь алкена — как нуклеофил.
C2H4 + Br2 →C2H4Br2 образуется бромид 1,2-дибромэтан
4. Электрофильное присоединение
Гидрогалогенирование соединений с кратной связью между атомами углерода:
C4H8 + HCl→C4H9Cl бутен превращается в алкилгалогенид
5. Радикальное присоединение
Полимеризация: Процесс, при котором маленькие молекулы (мономеры) соединяются в длинные цепочки (полимеры). Например, полимеризация этилена (C₂H₄) может происходить с помощью радикалов, образующих полиэтилен.
3. Реакции отщепления
— это реакции, в которых из молекулы удаляется небольшая группа атомов, обычно с образованием двойной связи или циклической структуры. Отщепление атома водорода происходит преимущественно от наименее гидрогенизированного атома углерода по правилу Зайцева
Примеры:
1. Дегидратация спиртов:
— Отщепление воды от этанола:
C2H5OH+C2H4 + H2O этанол превращается в этилен
2. Дегидрирование алканов:
— Отщепление водорода от пропана:
C3H8 -> C3H6 + H2 пропан превращается в пропен
3. Отщепление углекислого газа:
— Декарбоксилирование карбоновых кислот:
RCOOH→RH + CO2 карбоновая кислота превращается в углеводород и углекислый газ, обычно реакция протекает при нагревании в присутствии кислот или оснований
4. в реакциях с основами:
— Отщепление галогена и водорода:
RCH2CH2X + KOH→RCH=CH2 + HX + H2O алкилгалогенид превращается в алкен
4. Изомеризация
— это процесс, в ходе которого молекулы с одинаковой молекулярной формулой, но различной структурой или пространственным расположением атомов, превращаются друг в друга. Процесс протекает в присутствии катализаторов. Обычно это кислотные, щелочные или металлические катализаторы
Примеры:
1. Изомеризация алканов:
— Изомеризация н-бутана в изобутан:
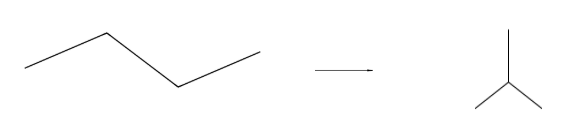
2. Изомеризация алкенов:
— Изомеризация 1-бутена в цис- и транс-2-бутен:

3. Изомеризация углеводородов с помощью катализаторов:
— Изомеризация циклоалканов:
C6H12->C6H12 например, циклопентан может изомеризоваться в метилциклобутан (при нагревании, в присутствии Al2O3)
4. Изомеризация спиртов:
— Изомеризация пропан-1-ола в пропан-2-ол (при нагревании, в присутствии Al2O3):
C3H8O->C3H8O
По теме конспекта можно проверить свои знания по этому тесту:




