Определение одноосновной карбоновой кислоты
Карбоновые кислоты представляют собой группу органических веществ, молекулы которых содержат одну или несколько карбоксильных групп (-COOH).
Строение одноосновных карбоновых кислот
Эти кислоты содержат две важные функциональные группы: карбонильную группу (-C=O) и гидроксильную группу (-OH). В карбонильной группе образуются две химические связи между атомами углерода и кислорода – одна сигма (σ)-связь и одна пи (π)-связь. Углеродный атом, входящий в состав карбоксильной группы, находится в состоянии sp²-гибридизации, при этом углы между связями составляют 120° градусов. Из-за более высокой электроотрицательности кислорода по сравнению с углеродом в этой группе возникают частичные электрические заряды на атомах.
Классификация одноосновных карбоновых кислот
Одноосновные алифатические карбоновые кислоты можно классифицировать на предельные (насыщенные), непредельные (ненасыщенные), ароматические и алициклические. Про ароматические и алициклические кислоты ты сможешь прочитать в этом конспекте.
Предельные одноосновные карбоновые кислоты представляют собой производные алканов, у которых один атом водорода заменен на карбоксильную группу.
Общую формулу для таких насыщенных одноосновных кислот можно записать как CnH2n+1COOH или Cn+1H2n+2O2.
Например, муравьиная и уксусная кислоты
Непредельные одноосновные карбоновые кислоты – это такие кислоты, в углеводородной цепи которых присутствуют кратные связи. Примером может служить пропеновая (также известная как акриловая) кислота.
Номенклатура одноосновных карбоновых кислот
Международная номенклатура
Согласно международной номенклатуре ИЮПАК, названия карбоновых кислот формируются следующим образом: выбирают самую длинную цепь углеродов, включающую карбоксильную группу (-COOH), и добавляют к названию соответствующего углеводорода суффикс «-овая» и слово «кислота«. Нумерацию начинают с первого углерода, который входит в состав карбоксильной группы. Например:
C3H3-C2H2-C1OOH — пропановая кислота;
CH3-CH(CH3)-COOH — 2-метилпропановая кислота.
Рациональная номенклатура
Для обозначения карбоновых кислот иногда применяется рациональная номенклатура, согласно которой к названию углеводорода (или его радикала) добавляется термин «карбоновая кислота». При этом атом углерода в составе карбоксильной группы не учитывается при нумерации цепи. Например:
CH3-C(CH3)2-COOH — трет-бутилкарбоновая кислота.
Тривиальная номенклатура
Некоторые карбоновые кислоты известны под своими традиционными (тривиальными) названиями, которые широко используются наряду с систематическими. Примеры таких названий приведены в таблице.
Предельные одноосновные карбоновые кислоты
| Тривиальное название | Название по ИЮПАК | Название соли | Формула |
| Муравьиная кислота | Метановая кислота | Формиаты | НСООН |
| Уксусная кислота | Этановая кислота | Ацетаты | CH3COOH |
| Пропионовая кислота | Пропановая кислота | Пропионаты | C2H5COOH |
| Масляная кислота | Бутановая кислота | Бутираты | C3H7COOH |
| Валериановая кислота | Пентановая кислота | Валераты | C4H9COOH |
| Капроновая кислота | Гексановая кислота | Капронаты | C5H11COOH |
| Пальмитиновая кислота | Гексадекановая кислота | Пальмитаты | С15Н31СООН |
| Стеариновая кислота | Октадекановая кислота | Стеараты | С17Н35СООН |
Непредельные одноосновные карбоновые кислоты
| Тривиальное название | Название по ИЮПАК | Название соли | Формула |
| Акриловая кислота | Пропеновая кислота | Акрилаты | CH2=CH–COOH |
| Метакриловаякислота | 2-Метилпропеновая кислота | Метакрилаты | CH2=C(СH3)–COOH |
| Кротоновая кислота | транс-2-Бутеновая кислота | Кротонаты | СН3 -CH=CH–COOH |
| Олеиновая | 9- цис-Октадеценовая | Олеаты | СН3(СН2)7СН=СН(СН2)7СООН |
| Линолевая | 9,12-цис-Октадекадиеновая | Линолеаты | СН3(СН2)4(СН=СНСН2)2(СН2)6СООН |
| Линоленовая | 9,12,15-цис-Октадекатриеновая | Линоленоаты | СН3СН2(СН=СНСН2)3(СН2)6СООН |
Изомерия одноосновных карбоновых кислот
Изомерия углеродного скелета
Одноосновные предельные карбоновые кислоты могут проявлять различные типы изомерии, среди которых одним из основных является изомерия углеродного скелета. Этот тип изомерии становится возможным начиная с бутановой кислоты (С4H8O2), так как именно с этого момента возможно образование различных структурных вариантов углеродной цепи.
Бутановая кислота
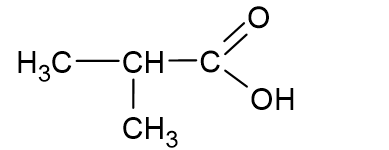
Изобутановая кислота
Межклассовая изомерия
Еще одной важной формой изомерии для одноосновных предельных карбоновых кислот является межкласссовая изомерия с участием сложных эфиров. Так, например, уксусная кислота (CH3COOH) имеет межкласссового изомера в виде метилового эфира муравьиной кислоты (HCOOCH3).
Уксусная кислота
Метиловый эфир муравьиной кислоты
Получение одноосновных карбоновых кислот
Лабораторные методы получения карбоновых кислот
1. Окисление спиртов, альдегидов.
Одним из распространенных методов синтеза карбоновых кислот является окисление спиртов и альдегидов. Альдегиды и первичные спирты могут быть окислены до соответствующих карбоновых кислот. В роли окислителей могут выступать различные реагенты, такие как перманганат калия (KMnO4), дихромат калия (K2Cr2O7), оксид меди (СuО) и другие.
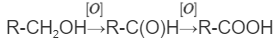
Примерами реакций окисления могут служить следующие процессы:
а) жёсткое окисление первичных спиртов
5CH3-CH2OH+4KMnO4+6H2SO4→ 5CH3-COOH+2K2SO4+4MnSO4+11H2O
б) окисление альдегидов
5CH3-CHO+2KMnO4+3H2SO4 → 5CH3-COOH+K2SO4+2MnSO4+3H2O
2. Гидролиз геминальных тригалогенпроизводных углеводородов
В процессе гидролиза геминальных тригалогенпроизводных углеводородов (то есть соединений, где все три атома галогена присоединены к одному и тому же атому углерода, обычно находящемуся на конце цепи в виде группы -СHal3) сначала образуется спирт, содержащий гидроксильные группы OH, связанные с тем же атомом углерода. Однако такой спирт крайне нестабилен и быстро теряет молекулу воды, превращаясь в соответствующую карбоновую кислоту.
R-CCl3+4NaOH→ R-COONa+3NaCl+2H2O
Образуется именно соль, а не кислота.
R-COONa+HCl→ R-COOH+NaCl
Например:
CH3-CCl3+4NaOH→CH3COONa+3NaCl+2H2O
CH3COONa+HCl→CH3COOH+NaCl
3. Омыление (гидролиз) сложных эфиров
Щелочное омыление (гидролиз) сложных эфиров приводит к образованию солей соответствующих карбоновых кислот. После этого на полученные соли воздействуют сильными минеральными кислотами, такими как соляная или серная, чтобы выделить исходную карбоновую кислоту.
R-COOR1+KOH→ R-COOK+R1OH
R-COOK +HCl→ R-COOH+KCl
Например:
CH3-COO-CH2-CH3+NaOH→CH3COONa+CH3-CH2OH
CH3COONa+H2SO4→CH3COOH+NaHSO4
4. Жёсткое окисление алкенов, например перманганатом калия в кислой среде
При жестком окислении алкенов происходит разрыв углеродной цепи вдоль двойной связи, и атомы углерода, находящиеся в месте разрыва, преобразуются в карбоксильные группы.
5CH3-CH=CH-CH3+8KMnO4+12H2SO4→10CH3COOH+8MnSO4+4K2SO4+12H2O
5.Окисление гидроксидом меди
6.Реакция “серебрянного зеркала”
7.Парофазное каталитическое окисление пропена
Специфические способы получения некоторых карбоновых кислот
Существуют особые методы синтеза для некоторых конкретных кислот. Муравьиную кислоту, например, получают путем сплавления гидроксида натрия с углекислым газом (оксидом углерода(II)), после чего полученный формиат натрия обрабатывают сильной кислотой.
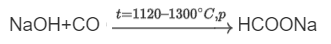
HCOONa+H2SO4→HCOOH+NaHSO4
Ещё один метод синтеза муравьиной кислоты заключается в каталитическом окислении метана кислородом из воздуха.
2CH4+3O2→2HCOOH+2H2O
Уксусная кислота образуется в результате брожения углеводов, таких как крахмал и сахар. Она становится конечным продуктом процесса спиртового брожения, если присутствует кислород. В промышленных условиях уксусную кислоту также синтезируют путем каталитического окисления бутана с использованием кислорода из воздуха.
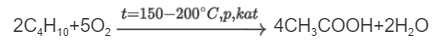
Нахождение в природе и применение карбоновых кислот
Карбоновые кислоты представляют собой важный класс соединений, встречающихся в составе натуральных животных жиров, растительных масел и восков. Эти вещества активно используются в различных отраслях промышленности, включая пищевую, фармацевтическую и органический синтез. Среди наиболее востребованных представителей этого класса — уксусная и муравьиная кислоты, играющие ключевую роль во многих реакциях органического синтеза.
Муравьиная кислота (HCOOH) находит свое применение в медицине, где она известна под названием «муравьиный спирт» (спиртовой раствор муравьиной кислоты концентрацией 1,25%). Кроме того, ее используют в пчеловодстве, органическом синтезе, а также для получения растворителей и консервантов. Благодаря сильным восстановительным свойствам, муравьиную кислоту ценят в ряде технологических процессов.
Уксусная кислота (CH₃COOH) служит популярным консервантом в пищевой промышленности. В химической отрасли она необходима для производства красителей, сложных эфиров, ацетилцеллюлозы, которая, в свою очередь, идет на изготовление ацетатного волокна, органического стекла и кинопленки. В фармацевтике уксусную кислоту задействуют при создании разнообразных медикаментов.
Масляная кислота (C₃H₇COOH) используется для создания пластификаторов и флотореагентов, что позволяет улучшить свойства полимерных материалов и повысить эффективность процессов обогащения полезных ископаемых.
Стеариновая (C17H35COOH) и пальмитиновая (C15H31COOH) кислоты служат основой для производства поверхностно-активных веществ и смазочных материалов, используемых в металлообработке. Это помогает снизить трение и износ оборудования, повышая качество обработки металлических изделий.
Олеиновая кислота (C₁₇H₃₃COOH) нашла своё применение в качестве флотореагента при обогащении руд цветных металлов, способствуя более эффективному извлечению ценных компонентов из минерального сырья.
Физические и химические свойства одноосновных карбоновых кислот
Физические свойства карбоновых кислот
Карбоновые кислоты обладают полярным строением благодаря наличию карбоксильной группы, что позволяет им образовывать межмолекулярные водородные связи. Способность к образованию этих связей объясняет хорошую растворимость низших кислот (от С1 до С4) в воде и этаноле. Высшие кислоты, напротив, хуже растворимы в воде, однако они легко растворяются в этиловом спирте и диэтиловом эфире. Эта особенность связана с гидрофобностью углеводородного радикала в молекуле кислоты: чем он крупнее, тем менее растворимой становится кислота в воде.
Низшие карбоновые кислоты представляют собой бесцветные жидкости с характерным резким запахом; начиная с пентановой (валериановой) кислоты, они становятся маслянистыми жидкостями, а высшие кислоты уже являются твердыми веществами без выраженного вкуса и запаха.
Межмолекулярная ассоциация карбоновых кислот также обусловлена наличием водородных связей между молекулами. Жидкие карбоновые кислоты, такие как муравьиная кислота, часто находятся в форме димеров:
В водных растворах димеры разлагаются на отдельные мономеры.
Химические свойства одноосновных предельных карбоновых кислот
Карбоксильная группа обладает полярной структурой, поэтому карбоновые кислоты демонстрируют общие свойства, типичные для всех слабых неорганических кислот.
Реакции карбоновых кислот, общие с неорганическими кислотами
1. Изменение окраски индикатора
Карбоновые кислоты относятся к слабым электролитам, поэтому растворы этих кислот способны изменять цвет индикаторов, таких как метилоранж и лакмус.
RCOOH↔RCOO— + H+
Константа диссоциации предельных монокарбоновых кислот снижается по мере увеличения количества атомов углерода в радикале.
2. Взаимодействие с активными металлами (щелочные и щелочноземельные металлы, за исключением Be и Mg) с выделением водорода
2CH3COOH+K→2CH3COOK+H2
3. Взаимодействие с основными и амфотерными оксидами металлов
MgO+2CH3COOH→(CH3COO)2Mg+H2O
4. Взаимодействие с основаниями с образованием соответствующих солей
CH3COOH+NaOH→CH3COONa+H2O
5. Взаимодействие с солями слабых кислот, например с карбонатами
Na2CO3+2HCOOH→2HCOONa+CO2+H2O
По мере увеличения числа атомов углерода в молекуле сила кислоты ослабевает. Поэтому муравьиная кислота, будучи самой короткой в ряду, является наиболее сильной среди них и классифицируется как кислота средней силы. Муравьиная кислота может вытеснять уксусную, поскольку она сильнее последней.
CH3COONa+HCOOH→CH3COOH+HCOONa
Реакции нуклеофильного замещения карбоновых кислот
Реакции нуклеофильного замещения у sp²-гибридизованного атома углерода карбоксильной группы представляют собой одну из ключевых групп реакций карбоновых кислот. Этот механизм позволяет карбоновым кислотам взаимодействовать с различными органическими соединениями, такими как спирты, амины, другие карбоновые кислоты, а также галогенирующими агентами (соединениями фосфора и серы).
1. Взаимодействие со спиртами (реакция этерификации)
Реакция взаимодействия карбоновых кислот со спиртами в присутствии катализаторов, таких как концентрированная серная кислота (H2SO4), приводит к образованию сложных эфиров.
RCOOH+R’OH↔RCOOR’+H2O
2. Взаимодействие с другими карбоновыми кислотами
При взаимодействии карбоновых кислот друг с другом в присутствии водоотнимающих агентов образуются ангидриды.
3. Взаимодействие с аммиаком и аминами
Когда на карбоновые кислоты воздействуют аммиаком (в газообразном состоянии или в растворе), первоначально формируются аммониевые соли. При сильном нагревании эти сухие аммониевые соли теряют воду и преобразуются в амиды. Например, общая реакция уксусной кислоты с аммиаком выглядит следующим образом:
CH3COOH+NH3→CH3CONH2+H2O
4. Образование галогенангидридов
Для хлорирования карбоновых кислот обычно применяют хлориды PCl5. В ходе этой реакции гидроксильная группа замещается на галоген, что ведет к образованию хлорангидридов.
RCOOH+PCl5→RCOCl+POCl3+HCl
Окислительно-восстановительные свойства карбоновых кислот
Карбоновые кислоты выступают в роли конечных продуктов окисления спиртов и альдегидов и характеризуются высокой стойкостью к воздействию окислителей. Исключение составляет муравьиная кислота, содержащая альдегидную группу, которая легко подвергается окислению. Подобно альдегидам, муравьиная кислота участвует в реакции «серебряного зеркала»:
HCOOH+2[Ag(NH3)2]OH→2Ag↓+(NH4)2CO3+2NH3+H2O
Восстановление карбоксильной группы возможно в присутствии мощных восстановителей, таких как алюмогидрид лития (LiAlH4). В процессе восстановления вначале формируется альдегид, который далее превращается в спирт.
Реакции по углеводородному радикалу, характерные для карбоновых кислот
Атомы водорода, связанные с α-углеродным атомом (то есть с атомом углерода, непосредственно связанным с карбоксильной группой), отличаются повышенной подвижностью, что создает условия для протекания реакций замещения. Например, при галогенировании в присутствии небольших количеств красного фосфора преимущественно образуется α-галогенкарбоновая кислота:
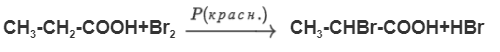
Непредельные углеводороды вступают в реакции:
1.Гидрирования
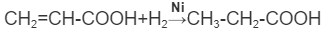
2.Присоединительного галогенирования
CH2=CH-COOH+Сl2→CH2Cl-CHCl-COOH
3.Гидрогалогенирование против правила Марковникова
CH2=CH-COOH+HCl→CH2Cl-CH2-COOH
4.Гидратация
CH2=CH-COOH+H2O→CH2OH-CH2-COOH
5.Мягкого окисления
3CH2=CH-COOH+2KMnO4+2H2O→2CH2OH-CHOH-COOK+CH2OH-CHOH-COOH+2MnO2
6.Жёсткого окисления в нейтральной среде
3CH2=CH-COOH+10KMnO4→3СOOH-COOK+3K2CO3+10MnO2+KOH+4H2O
7.Жёсткого окисления в кислой среде
5CH2=CH-COOH+12KMnO4+18H2SO4→15CO2+6K2SO4+12MnSO4+28H2O
Памятку по химическим свойствам карбоновых кислот можно скачать по ссылке.
Чтобы закрепить теоретический материал по данной теме, можно пройти тест:




