Фенолы — класс органических соединений, состоящих из одной или нескольких гидроксильных групп, которые связаны с ароматическим кольцом.
Общая формула класса имеет следующий вид: С6H6O или С6H5OH (рис.1).
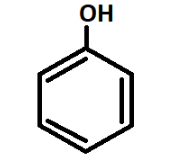
Классификация
Разделение фенолов на некоторые виды основано на количестве гидроксильных групп. Так, фенолы подразделяют на:
- Одноатомные фенолы (аренолы) — одна OH-группа. Общая формула CnH2n-7OH (CnH2n-6O);
- Двухатомные фенолы (арендиолы). Общая формула CnH2n-8(OH)2 или CnH2n-6O2;
- Многоатомные фенолы — 3 и более OH-групп.
Номенклатура
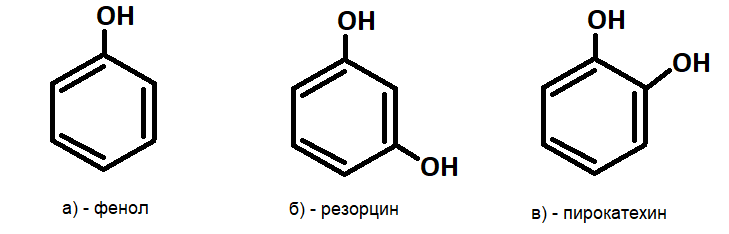
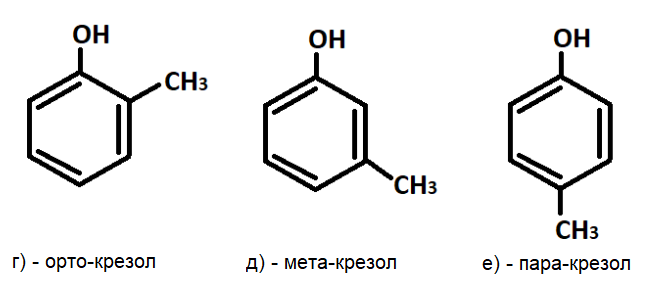
Большинство фенолов имеют тривиальные названия, которые были утверждены в соответствии с номенклатурой IUPAC (International Union of Pure and Applied Chemistry), например, фенол, резорцин, пирокатехин и крезол (рис.2 а-е).
В общем случае названия фенолов получаются, исходя из нумерации атомов углерода, при этом выбирают кратчайший путь. Затем начинают с того атома углерода, который связан с гидроксильной группой. Если же в молекуле фенола имеется более старшая группа по отношению к OH-группе (сульфо-, карбокси- и др.), то цикл начинают нумеровать с того атома углерода, при котором стоит эта группа, то есть «по старшинству», согласно правилу Кана-Ингольда-Прелога, которое звучит так: самым старшим считается заместитель, у которого больше атомный номер.
Прежде, чем называть какое-либо соединение, необходимо:
- Пронумеровать углеродную цепь так, чтобы старшая группа получила наименьший номер;
- Определить в молекуле функциональные группы и выделить среди них старшую, которая будет указана в суффиксе названия, остальные группы – в приставке.
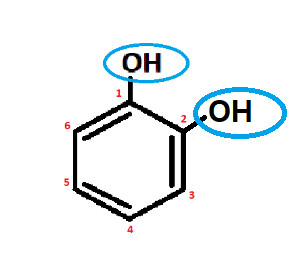
Стоит отметить, что нумерация заместителей начинается с атома углерода при гидроксильной группе и продолжается по кратчайшему пути. В начале названия перечисляются заместители с указанием их положения, а в конце добавляют «фенол» (рис.3).
Важно: Фенолы, в которых есть две или более гидроксильных -ОН групп, называют немного иначе. Перечисляют гидроксильные группы с указанием их положения и в конце добавляют «бензол» (рис.4).
Пример:

Электронное строение фенола
Фенолы выделены в отдельный класс не случайно, потому что наличие гидроксильной группы рядом с бензольным кольцом обуславливает уникальные свойства таких молекул.
Рассмотрим строение молекулы фенола. Он, в свою очередь, состоит из шести атомов углерода, которые образуют правильный шестиугольник. Почему же образуется данная фигура? Дело в sp2-гибридизации электронных орбиталей шести атомов углерода. Каждый атом углерода в кольце связан со своим соседом посредством σ-связи. Однако не все р-электроны каждого атома углерода участвуют в образовании данного вида связей. Оставшаяся часть образует две части единого шестиэлектронного π-облака, которое проходит через всё ароматическое ядро.
Кроме того, молекула фенола содержит гидроксильную группу – заместителя I рода, то есть она способствует повышению электронной плотности в бензольном кольце. Чем это обусловлено? Тем, что одна из неподеленных пар электронов атома кислорода OH-группы вступает в сопряжение с π-системой бензольного кольца: происходит смещение неподеленной пары в сторону ароматического ядра (рис.5).
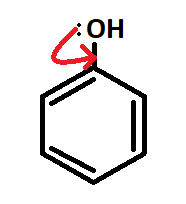
Таким образом, увеличивается полярность связи O-H, что сказывается на свойствах фенола:
- Повышается способность к замещению атомов водорода в орто- (можно запомнить как “около”) и пара-положениях (напротив) бензольного ядра (рис.6а,б);
- Молекулы фенола диссоциируют в водных растворах по кислотному типу.
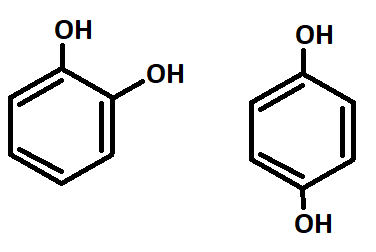
Рис.6а,б — положения заместителей
Изомерия
Для фенолов характерна структурная изомерия:
— Изомерия положения заместителей в бензольном кольце (рис.7)
— Изомерия положения групп –ОН в многоатомных спиртах(орто-, пара- и метаположения) (рис.8)
— Межклассовая изомерия с ароматическими спиртами, простыми эфирами (рис.9 а-в)
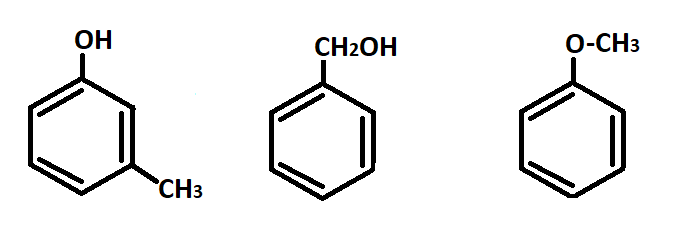
Рис.9 а-в
Физические свойства
- При обычных условиях — это бесцветное кристаллическое вещество. На воздухе приобретает розоватый оттенок;
- Обладает характерным запахом;
- Легко плавится, температура плавления составляет всего 40,9 °C;
- При комнатной температуре фенол ограниченно растворяется в воде, но при 70 °C и выше он смешивается с водой в любых соотношениях;
- Хорошо растворяется в органических растворителях;
- Фенол токсичен.
Химические свойства
Реакции фенолов могут проходить как по гидроксильной группе, так и по бензольному кольцу.
- Реакции по гидроксильной группе
1.1. Кислотность фенолов
Свойства фенолов сильно отличаются от одноатомных спиртов, потому что гидроксид-ион обладает меньшей термодинамической стабильностью по сравнению с фенолят-ионом, в котором отрицательный заряд рассеивается с участием атомов углерода бензольного кольца.
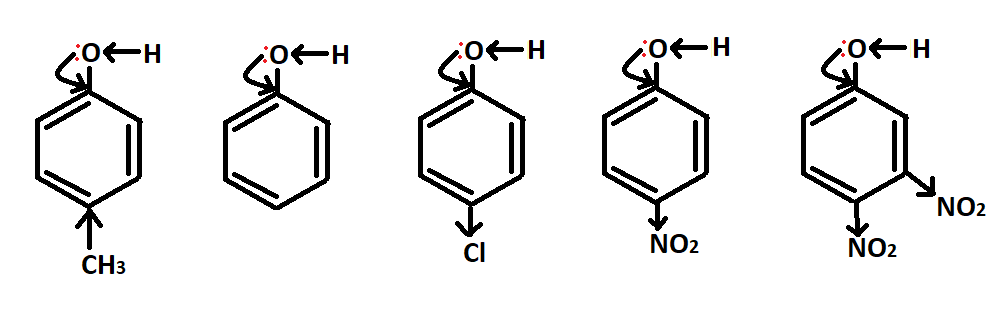
Если вводить в ароматическое кольцо фенолов различные заместители, то кислотные свойства фенолов изменяться. Так, на рис.10 мы видим, что Cl-ион уменьшает электронную плотность в углеродной цепи, оттягивая ее на себя (такие заместители называются электронноакцепторными) – -NO2, -SO3H, — COH, -CN. Следовательно, кислотные свойства будут только усиливаться. Возможен вариант с заместителями, которые, напротив, являются электронодонорными: повышают электронную плотность, уменьшая кислотные свойства молекулы, – -CH3, -C2H5, -OH (рис.10).
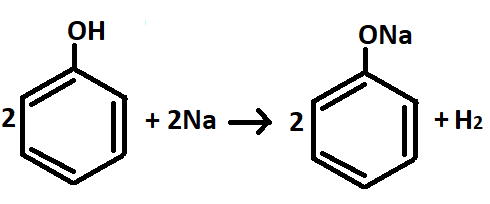
Фенол, проявляя кислотные свойства, реагирует с щелочами и щелочными металлами, образуя соли – феноляты (рис.11,12).
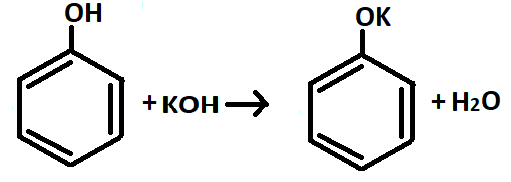
Стоит отметить, что данная реакция (рис.12) характерна только для фенолов, но не для спиртов. Это можно объяснить тем, что в фенолах бензольное кольцо оттягивает на себя избыточную электронную плотность с атома кислорода гидроксильной группы. Та, в свою очередь, становится более подвижной, что увеличивает кислотные свойства фенолов.
- Реакции по бензольному кольцу
Фенол вступает в реакции электрофильного замещения в ароматическом кольце.
- Электрофильное замещение — тип химической реакции, характерный для ароматических соединений, в которой атом водорода в ароматическом кольце заменяется на электрофильную группу.
В качестве примера электрофильной группы можно привести:
- Положительные ионы (катионы). Например, ионы гидрония (H₃O⁺), карбокатионы (R⁺) и катионы металлов, такие как ионы алюминия (Al3⁺).
- Карбокатионы. Органические молекулы, которые обладают высоким дефицитом электронов и готовы вступать в реакцию с нуклеофилами с образованием новых связей. Примерами являются метилкатион (CH₃⁺), этилкатион (C₂h₅⁺) и т.д.
Гидроксильная группа как электронодонорный заместитель ориентирует замещение в орто- и пара-положения бензольного кольца.
Итак, рассмотрим некоторые реакции электрофильного замещения фенола:
- — Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол!).
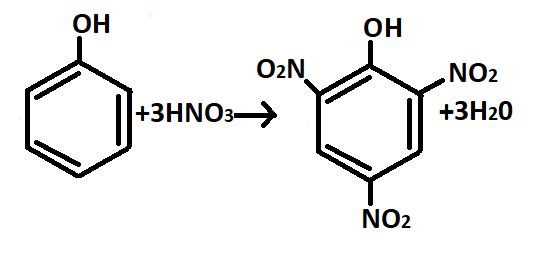
- — Нитрование. Под действием 20%-ной азотной кислоты фенол легко превращается в смесь орто- и пара-нитрофенолов. При использовании концентрированной азотной кислоты образуется 2,4,6-тринитрофенол (пикриновая кислота) (рис.13).
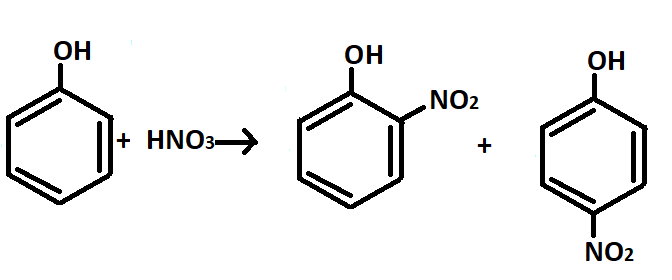
Если будем использовать разбавленную азотную кислоту, то будет протекать следующая реакция (рис.14):
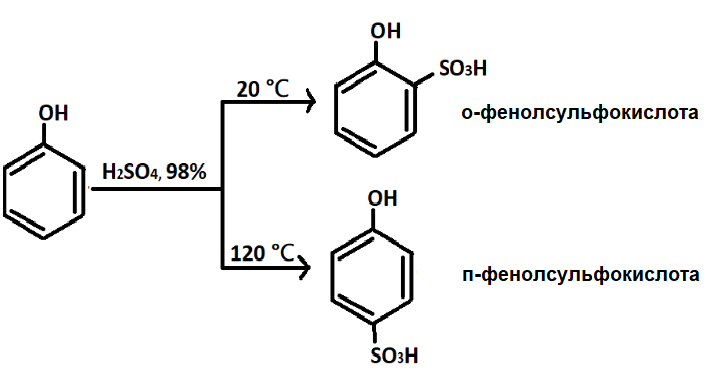
— Сульфирование. Электрофильным реагентом является серная кислота. Замещение в феноле направлено в орто- и пара-положения (рис.15).
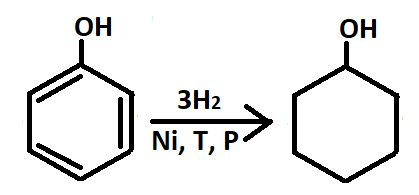
— Гидрирование под действием катализатора
— Поликонденсация с альдегидами
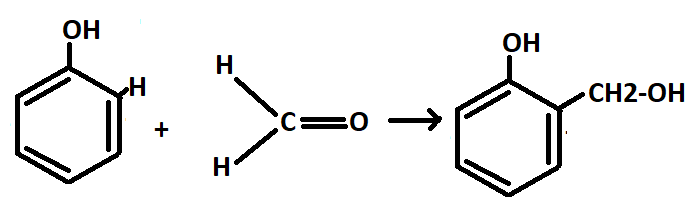
Получение
Выделяют несколько способов получения фенола:
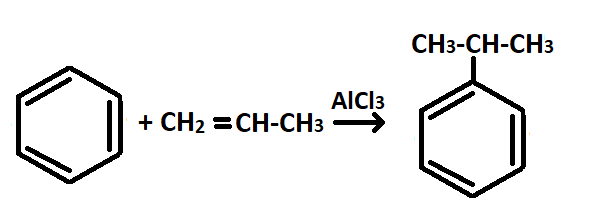
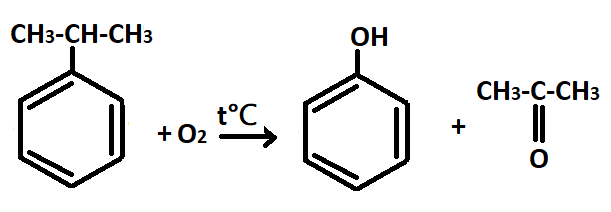
— Кумольный способ — метод получения фенола и ацетона из кумола.
Процесс протекает в 2 стадии.
1 стадия: алкилирование бензола пропеном:
2 стадия: окисление изопропилбензола кислородом воздуха:
— Выделение из каменноугольной смолы
Метод основан на перегонке каменноугольной смолы, которая выделяется в виде смеси твердых белых кристаллов с резким запахом.
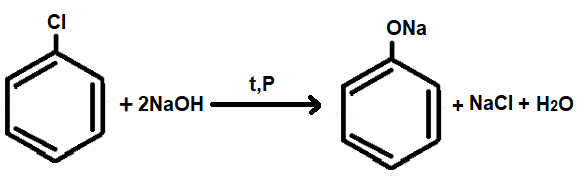
— Гидролиз галогенбензолов
Сначала происходит обработка хлорбензола избытком щелочи в условиях высокого давления и температуры. В ходе химической реакции образуется водный раствор фенолята натрия (рис.20):
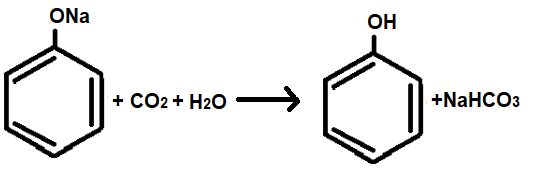
Затем через раствор фенолята натрия пропускают углекислый газ. В результате синтезируется фенол (рис.21 (а)):
Применение
Фенол — это органическое соединение, которое имеет множество применений в различных отраслях. Вот некоторые из них:
1. Производство пластмасс: фенол используется для синтеза бакелита и других термореактивных смол.
2. Антисептики и дезинфицирующие средства: благодаря своим антисептическим свойствам, фенол применяется в медицинских дезинфекционных средствах.
3. Производство красителей: фенол служит сырьем для синтеза различных красителей и пигментов.
4. Фармацевтика: используется в производстве некоторых лекарственных препаратов и как промежуточное соединение в химических реакциях.
5. Консерванты: в пищевой промышленности фенол может использоваться как консервант (в ограниченных количествах).
6. Химическая промышленность: фенол является важным исходным продуктом для синтеза других химических соединений, таких как пластики, растворители и т.д.
7. Производство клеев и герметиков: используется в производстве клеевых составов, особенно на основе фенолформальдегидных смол.
8. Синтез ароматических соединений: фенол служит сырьем для получения различных ароматических веществ.
Таким образом, мы рассмотрели ключевые аспекты темы «Фенолы». Инфографику по данной теме можно скачать по ссылке. Самое время закрепить свои знания и пройти тест!




