Общие понятия
Углеводы — это органические соединения, состоящие из кислорода, углерода и водорода, содержащие альдегидные/кетонные и гидроксильные группы. Общая формула углеводородов — Cn(H2O)m (кроме дезоксирибозы).
Классификация
- Углеводы могут существовать в двух формах: в линейной (ациклической) и циклической (когда линейная молекула замыкается в гетероцикл с участием кислородного атома). Есть углеводы, способные существовать лишь в одной форме (как правило, углеводы с длинной цепью склонны к замыканию, а короткие, наоборот, существуют в линейной форме). Типичный пример — глюкоза, циклизующаяся в растворе:
В общем случае, если углевод имеет циклическую структуру, то его изображают “сбоку” для упрощения восприятия сложной структуры. - по растворимости в воде
- нерастворимые (к этой категории относятся все полисахариды: крахмал, целлюлоза, хитин и пр.)
- растворимые (все моно- и дисахариды, например, глюкоза и сахароза)
- по числу звеньев
- — моносахариды — моноциклические соединения
- — дисахариды — состоят из остатков двух одинаковых или разных моносахаридов, соединённых определённым образом
- — полисахариды — полимерные соединения, состоящие из большого количества остатков моносахаридов
- по числу атомов углерода в структурном звене
- триозы
- тетрозы
Эритроза
- пентозы (рибоза и дезоксирибоза)
- гексозы (глюкоза)
и т.д.
- по конфигурации (энантиомеры — зеркальные отражения). Хиральный атом углерода — sp3-гибридизованный с тремя заместителями
L-ряд
D-ряд
Отличие в том, что у D-ряда предпоследний в цепи гидроксил расположен справа (на формуле Фишера), а у L-ряда — слева. Природные углеводы, как правило, относятся к D-типу. - по химическим свойствам
- восстанавливающие (альдегидные свойства, связь с участием спиртового кислорода) Примеры: мальтоза, лактоза, глюкоза
- невосстанавливающие (не участвуют в ОВР, связь между звеньями осуществлена без участия спиртового кислорода). Примеры: сахароза, полисахариды
- негидролизующиеся — все моносахариды. Не способны подвергаться процессу гидролиза — распаду на составные звенья (т.к. образованы единственным структурным звеном)
- гидролизующиеся — ди- и полисахариды — способны в определённых условиях разлагаться на моносахариды.
Типичные примеры (со структурными формулами)
- глюкоза: существует в двух формах (см. выше)
- рибо-и дезоксирибоза
- лактоза
- сахароза
- галактоза (пространственный изомер глюкозы)
- крахмал и целлюлоза (различие в том, тто крахмал состоит из звеньев альфа-, а целлюлоза из бета-глюкозы, также молекулы крахмала разветвлены)
- крахмал и целлюлоза (различие в том, тто крахмал состоит из звеньев альфа-, а целлюлоза из бета-глюкозы, также молекулы крахмала разветвлены)
Физические свойства
- Моно- и дисахариды растворимы в воде, имеют сладкий вкус, низкую температуру плавления
- Полисахариды в большинстве своём нерастворимы, безвкусны
Методы получения
- фотосинтез — происходит в зелёных клетках растений при помощи хлорофилла: CO2 + H2O = C6H12O6
- кислотный гидролиз полисахаридов (например, нагревание крахмала в растворе серной кислоты) — высокомолекулярное соединение разлагается на мономеры
- синтез Бутлерова из формальдегида в присутствии солей кальция n(HCOH) = (CH2O)n
неудобен из-за низкой селективности, так трудно получить необходимый компонент — в ходе реакции можно получить лишь трудноразделимую смесь веществ - ферментативный гидролиз — под действием ферментов (напр. амилазы) крахмал может гидролизоваться до моносахаридов.
Химические свойства
- полное окисление до углекислого газа и воды (горение)
C6H12O6 + 6O2 = 6CO2 + 6H2O - окисление концентрированной серной кислотой (обугливание, выделение газов вследствие окисления углевода H2SO4)
C12H22O11+H2SO4 → C + H2O + SO2 
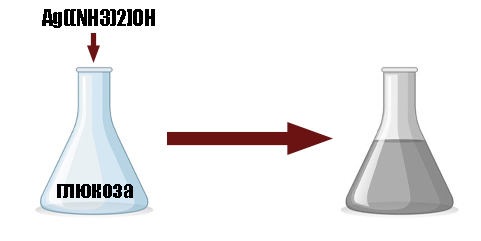
- реакция восстанав-щих углеводов с гидроксидом диамминсеребра — реакция серебряного зеркала (качественная реакция на альдегиды, поэтому реакция протекает только с углеводами, содержащими альдегидную группу, например, с глюкозой)
C6H12O6 + 2[Ag(NH3)2]OH = C6H11O7NH4 + Ag + NH3 + H2O
В результате поверхность сосуда покрывается тонким слоем серебра, благодаря чему реакция получила своё название. В качестве побочного продукта получаем глюконовую кислоту (в виде аммонийной соли)глюконовая кислота
- реакция с гидроксидом меди (2) при нагревании — красный осадок Cu2O — глюкоза окисляется до глюконовой кислоты
C6H12O6 + Cu(OH)2 = C6H12O7 + Cu2O + H2O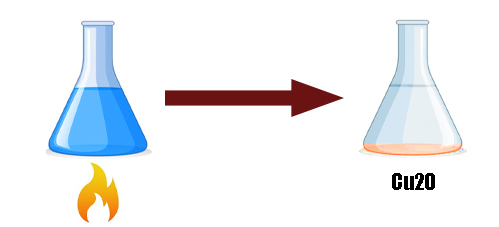
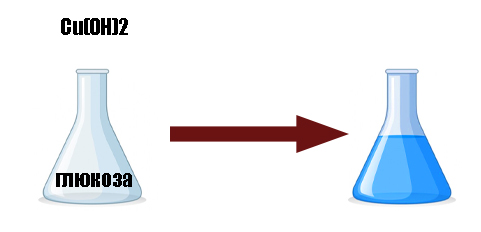
- свежий гидроксид двухвалентной меди с глюкозой и пр. восстанавливающими углеводами дают насыщенно-синий раствор из-за образования комплексного соединения.
- окисление бромной водой — альдозы окисляются бромной водой до соответствующих кислот, обесцвечивая её
C6H12O6 + Br2 = C6H12O7 + HBr + H2O
- спиртовое брожение — глюкоза при помощи микроорганизмов превращается в этанол
- молочнокислое брожение — глюкоза превращается в молочную кислоту
Роль в биологических процессах
- энергетическая и запасающая (животные запасают гликоген, растения — крахмал, далее используют для получения энергии)
- структурная (клетчатка в растениях)




