Важные величины и формулы для их вычисления:
Количество вещества (n) ⃰ – относительная величина, которая характеризует число частиц, содержащихся в веществе.
1 моль вещества содержит 6,02*1023 молекул
Формула для расчета:
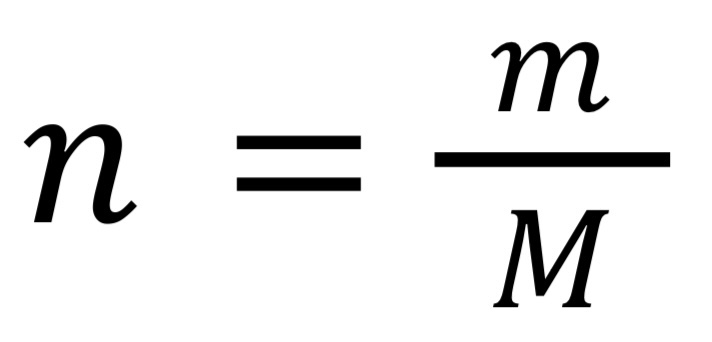
где m — масса вещества (г),
M — молярная масса вещества (г/моль)
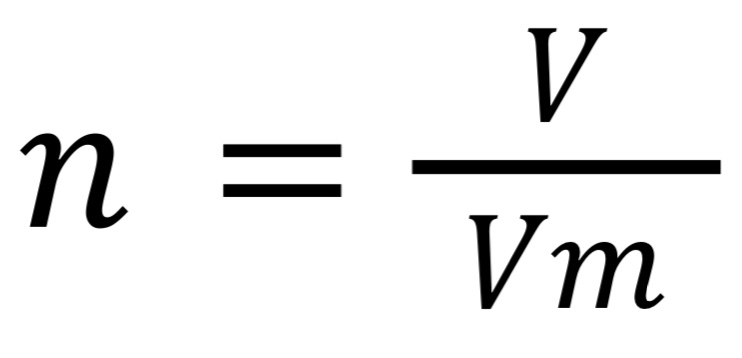
где V — объем вещества (л),
Vm — молярный объем вещества,
Vm = 22,4 моль/л
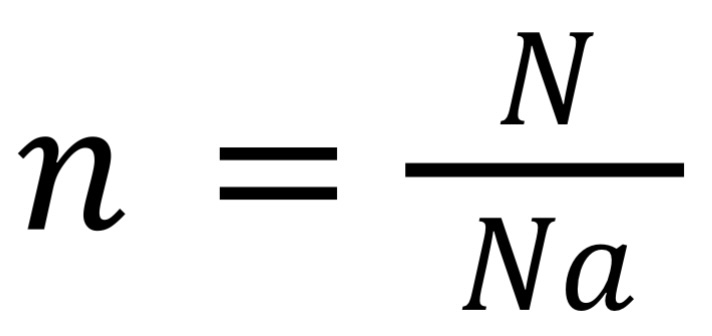
где N — число молекул,
NA — постоянная Авогадро,
NA = 6,02*1023, моль-1
Массовая доля выхода вещества в реакции (η) ⃰ ⃰ – это отношение масс (объемов) получившихся на практике веществ к массе (объему), которая была рассчитана теоретически.
Формула для расчета:
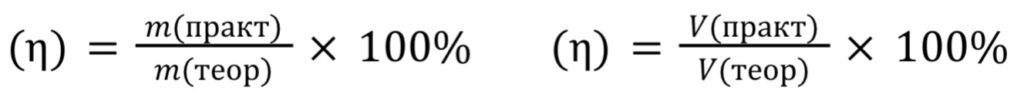
Массовая доля вещества(ω) – отношение массы чистого вещества к массе всего раствора.
Формула для расчета:
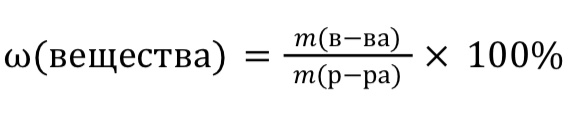
Массовая доля примеси (ω) ⃰ ⃰ ⃰ – отношение массы примеси к массе всей смеси.
Формула для расчета:
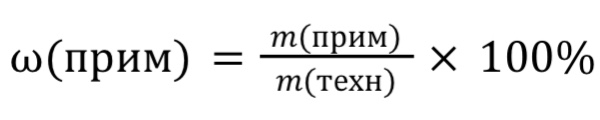
, где m(техн)=m(чист) + m(прим)
Уравнение химической реакции показывает, какие вещества и в каком количестве будут реагировать друг с другом, а также какие вещества и в каком количестве будут образовываться в ходе такого взаимодействия.
Коэффициенты в уравнениях обозначают количество молекул вещества, которое необходимо для того, чтобы исходные вещества прореагировали.
Коэффициент – число перед формулой.
Схематичное уравнение реакции 2А+2Б=2АБ показывает, что при взаимодействии 2 моль вещества А и 2 моль вещества Б образуется 2 моль вещества АБ.
n[моль] – количество вещества ⃰
Иногда бывает, что вещества реагируют друг с другом в соотношении 1:1, тогда коэффициенты не нужны. Но чаще протекают реакции с гораздо более сложными соотношениями. Уравнения таких реакции особенно важно записать правильно, расставив необходимые коэффициенты.
Пример 1:
SO3 + H2O = H2SO4
(одна молекула оксида серы (VI) реагирует с одной молекулой воды с образованием одной молекулы серной кислоты)
n(SO3):n(H2O):n(H2SO4)=1:1:1
- n(SO3)=n(H2O)=n(H2SO4)= 1 моль
Пример 2:
2H2 + O2 = 2H2O
(две молекулы водорода реагируют с одной молекулой кислорода с образованием двух молекул воды)
n(H2):n(O2):n(H2O)=2:1:2
Допустим, что мы знаем количество вещества кислорода, тогда, чтобы найти количество вещества:
- n(H2)=n(O2)×2
- n(H2O)=n(O2)×2
Пример 3:
4Fe + 3O2 = 2Fe2O3
(четыре молекулы железа реагируют с тремя молекулами кислорода с образованием двух молекул оксида железа (III))
n(Fe):n(O2):n(Fe2O3)=4:3:2
Допустим, что мы знаем количество вещества кислорода, тогда, чтобы найти количество вещества:
- n(Fe)=n(O2)×4
- n(Fe2O3)=n(O2)×2
При решении задач, исходя из мольного соотношения по стехиометрическим коэффициентам, мы можем рассчитать точное количество продукта реакции – это теоретический выход продукта реакции.
На практике теоретические расчеты не выполняются и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано – это практический выход продукта реакции.
Теоретический и практический выходы реакции могут не совпадать из-за разных причин: потери в ходе проведения реакции, побочные процессы и т.д.
Отношение практического количества продукта к теоретическому называется массовой долей выхода вещества (η) ⃰ ⃰
Задача:
Пары брома объемом 15 л смешали с избытком водорода, в результате из смеси выделили 27 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
- Составим уравнение реакции:
H2+Br₂ ⭢ 2HBr
- Найдем количество вещества Br2:
n(Br2)= V÷Vm = 15÷22,4 = 0,67 моль
- Найдем теоретическое значение количества вещества HBr:
n(HBr)теор= n(Br2)×2 = 0,67×2 = 1,34 моль
- Найдем практическое значение количества вещества HBr:
n(HBr)пр= V÷Vm = 27÷22,4 = 1,21 моль
- Найдем практическое и теоретическое значения масс:
m(HBr)пр= n(HBr)пр×M = 1,21×81 = 98,01 г
m(HBr)теор= n(HBr)теор×M = 1,34×81 = 108,54 г
- Найдем массовую долю выхода HBr:
η(HBr)= m(пр)÷m(теор) = 98,01÷108,54 = 0,902 = 90,2%
Любое вещество может содержать примеси – дополнительные вещества, доля которых в основном соединении невелика.
Содержание примесей в техническом образце рассчитывается с помощью массовой доли примеси (ω) ⃰ ⃰ ⃰.
Задача:
При прокаливании 300 г натриевой селитры (нитрат натрия) получили 27 л кислорода. Какова массовая доля примесей в селитре?
- Составим уравнение реакции:
2NaNO3 ⭢ 2NaNO2 + O2
- Найдем количество вещества O2:
n(O2)= V÷Vm = 27÷22,4 =1,21 моль
- Найдем количество вещества NaNO3:
По уравнению реакции коэффициент перед NaNO3 – 2, коэффициент перед O2 – 1.
Составим пропорцию исходя из коэффициентов реакции.
x моль (NaNO3) соответствует 1,21 моль (O2) – (по расчетам)
2 молекулы (NaNO3) соответствуют 1 молекуле (O2) – (по уравнению)
или:
x моль – 1,21 моль
2 молекулы – 1 молекула
→ n(NaNO3)= (2×1,21)÷1 = 2,42 моль
- Найдем массу чистого (без примесей) NaNO3:
m(NaNO3)= n(NaNO3)×M = 2,42×85 = 205,7 г
- Найдем массу примесей:
m(примеси)= m(NaNO3)техн-m(NaNO3)чист = 300-205,5 = 94,5 г
- Найдем массовую долю примесей:
ω(прим)= m(прим)÷m(NaNO3)техн = 94,5÷300 = 0,313 = 31,3%
Скачать памятку по формулам можно тут.
Пройти тестирование по теме можно здесь:




