Электролиз — это окислительно-восстановительная реакция, которая сопровождается разложением воды и веществ, входящих в состав смеси, идет при прохождении постоянного электрического тока через раствор электролита.
Электролит — это вещество, которое проводит электрический ток либо за счет диссоциации на ионы в растворах или расплавах, либо за счет движения ионов в кристаллических решетках твердых электролитов.
Электрод — это проводник, через который электрический ток проходит в газ или жидкость.
Есть два вида электродов:
Катод — это электрод, который заряжен отрицательно
Анод — это электрод, который заряжен положительно
Также электроды классифицируются на:
Инертные — не подвергаются химическим превращениям при электролизе, например, графит или платина
Не инертные — подвергаются химическим превращением при электролизе, например, медь и другие металлы
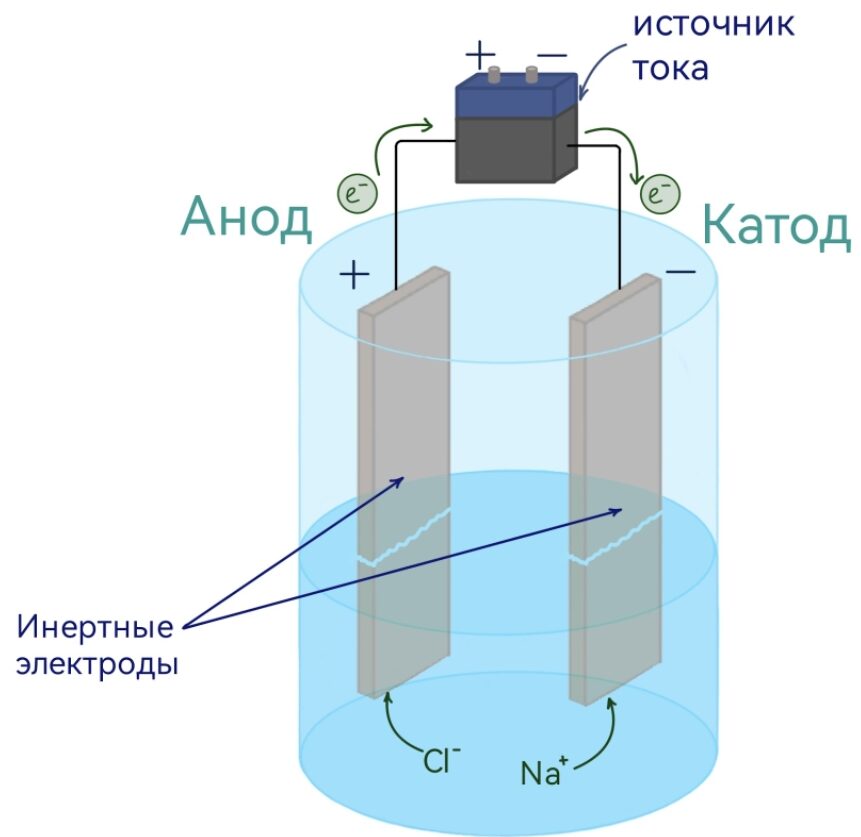
Установка для электролиза:
Электролиз классифицируется на:
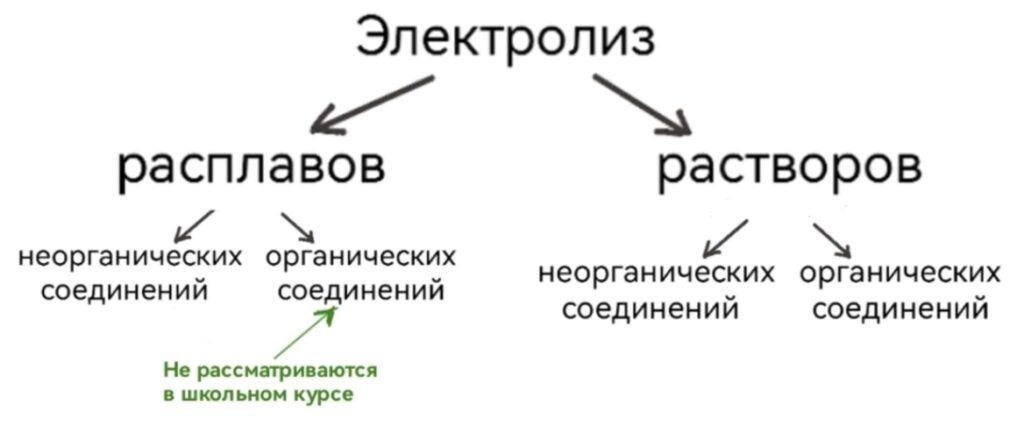
Электролиз расплавов
Это электролиз твердых (кристаллических) веществ. Проще всего рассмотреть данный процесс на примере кристаллической пищевой соли — NaCl.
NaCl при сильном нагреве начинает плавится, при этом образуются подвижные ионы хлора и натрия, которые освободились из кристаллической решетки. Затем через данный расплав проводится электрический ток и получается следующая запись:
K—: 2Na++ 2e— = 2Na0
A+: 2Cl— — 2e— = Cl2
Суммарное уравнение электролиза:
2Na++ 2Cl— = 2Na0 + Cl2
Мы опускаем в расплав NaCl инертные электроды, которые присоединены к источнику тока, при этом ионы начинают направленно двигаться: катионы движутся к катоду, анионы к аноду и отдают электроны.
Электролиз растворов
Это окислительно-восстановительный процесс, в котором участвуют ионы металла, кислотного остатка, а также ионы воды.
Перед тем, как мы рассмотрим электролиз неорганических соединений и органических соединений, обратимся к тому, как ведет себя вода при воздействии постоянного электрического тока.
K—: 2H2O + 2e— = H2 + 2OH—
A+: 2H2O — 4e— = O2 + 4H+
Суммарное уравнение электролиза:
2H2O = 2H2 + O2
Возьмем к примеру NaF, его электролиз будет идентичным электролизу воды, с чем же это связано?
Это связано с активностью металлов, как катионов, и с способностью окисляться кислотных остатков, как анионов.
Рассмотрим табличку, которая вам поможет понять, какие процессы будут происходить на катоде и на аноде:
Таблица 1. Катодные процессы при электролизе растворов солей
| Электрохимический ряд напряжения металлов | |||
| Очень активные металлы | Средне активные металлы | Водород | Неактивные металлы |
| Li Rb K Ba Sr Ca Na Mg Al | Mn Zn Cr Fe Cd Co Ni Sn Pb | H2 | Sb Bi Cu Hg Ag Pt Au |
| Men+ не восстанавливаются | Men+ + ne— = Me0 2H2O + 2e— = H2 + 2OH— | 2H+ + 2e— = H2 | Men+ + ne— = Me0 |
| 2H2O + 2e— = H2 + 2OH— | |||
Таблица 2. Анодные процессы при электролизе растворов солей
| Анионы | |||
| Бескислородные анионы | Кислородсодержащие анионы | ||
| Фтор | Все остальные | В щелочной среде | В кислой и нейтральной средах |
| Cl—, Br—, I—, S и тд | OH— | SO32-, PO43-, NO3—, SO42- | |
| 2H2O — 4e— = O2 + 4H+ | Am- — me— = A0 | 4OH— — 4e— = O2 + 2H2O | 2H2O — 4e— = O2 + 4H+ |
У фторидов и кислородсодержащих анионов в кислой и нейтральной среде процесс анодного окисления происходит одинаково. А у бескислородных (у всех кроме фторидов) на аноде будет выделяться простое вещество соответствующее аниону.
Теперь поподробнее рассмотрим электролиз растворов неорганических соединений.
Например, NaCl раствор:
K—: 2H2O + 2e— = H2 + 2OH—
A+: 2Cl— — 2e— = Cl2
Суммарное уравнение:
2NaCl + 2H2O = H2 + Cl2 + 2NaOH
Получается, что на катоде будет выделяться водород, на аноде — хлор. При этом среда раствора становится щелочной, поскольку в растворе образуется щелочь. Так будет всегда при электролизе солей активных металлов и бескислородных кислотных остатков (кроме фторида).
Например, CuSO4 раствор:
K—: Cu2+ + 2e— = Cu0
A+: 2H2O — 4e— = O2 + 4H+
Суммарное уравнение:
CuSO4 + 2H2O = Cu + O2 + 2H2SO4
Получается, что на катоде будет выделяться медь, на аноде — кислород. При этом среда раствора становится кислой, поскольку в растворе образуется сильная кислота. Так будет всегда при электролизе солей неактивных металлов и кислородосодержащих кислотных остатков.
Для органических соединений картина процесса немного отличается. Для того, чтобы разобраться в этом нужно обратить внимание на следующую схему (электролиз на примере ацетата натрия):
Суммарное уравнение:
2CH3COONa + 2H2O = H2 + CH3-CH3 + 2CO2 + 2NaOH
Таким образом, на катоде — водород, на аноде — соответствующий углеводород, состоящий из удвоенного радикала кислотного остатка, углекислого газа, а в растворе — гидроксид натрия. При этом среда раствора становится щелочной.
Также приведем пример с формиатом меди:
K—: Cu2+ + 2e— = Cu0
A+: 2HCOO— — 2e— = 2CO2 + H2
Суммарное уравнение:
Cu(HCOO)2 = Cu + 2CO2 + H2
Получается, что на катоде будет выделяться медь, на аноде — углекислый газ и водород. При этом среда раствора становится нейтральной.
Для решения задач
Для некоторых задач требуется узнать силу тока в электродном процессе или, например, требуется определить массу вещества, при этом, зная только то, сколько прошло электрического тока через раствор. Для этого используются законы Фарадея.
Формулы, которые понадобятся для расчетов:
Применение электролиза в промышленности
- В металлургической промышленности с помощью данного процесса получают чистые активные металлы
- В химической промышленности с помощью данной реакции получают такие простые вещества, как:
- кислород ( из растворов щелочей, кислот, сульфатов и нитратов щелочных металлов)
- фтор (из расплава фторида калия)
- водород ( из водных растворов солей активных металлов)
- хлор и другие галогены, кроме фтора (из растворов или расплавов галогеноводородов)
- алюминий (из оксида алюминия в расплаве с криолитом)
- такие сложные вещества, как:
- щелочи (из раствора поваренной соли (хлорид натрия))
- бертолетову соль (из раствора хлорида калия в присутствии с хроматом калия)
- и так далее.
- Электролиз используют для нанесения металлических покрытий, это нужно для того, чтобы предотвратить коррозию.
Вы можете скачать инфографику по определению продуктов электролиза здесь.
А проверить свои знания по теме можно по этому тесту:




