“Свойства вещества зависят не только от того,какие атомы и в каком количестве входят в состав молекулы,но и от их расположения”
Бутлеров А.М.
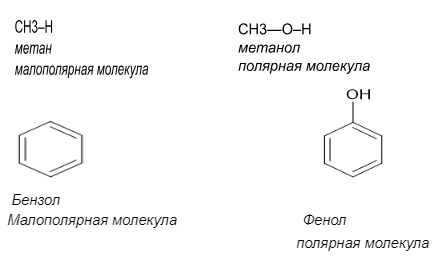
В школьном курсе органической химии большое значение отводится ковалентной,ионной связи,но ионная связь редко встречается в органических соединениях,так как углерод редко образует собственные ионы.Поэтому основной вид связи в органических соединениях-ковалентная полярная и неполярная связи.
Ниже представлены ссылки на учебные материалы по видам связи в органической химии,теории гибридизации и механизмах их образования (самостоятельное повторение).
1.https://orgchem.ru/chem1/p3_22.php
2.https://orgchem.ru/chem1/p4_2.php
Взаимное влияние строения вещества и его свойств связано с подвижностью электронной плотности .Под электронной плотностью понимают распределение электронов(общих электронных пар и свободных валентных электронов) в пространстве атомов и молекул.
Если смещение электронной плотности происходит по простым связям-проявляется индуктивный эффект (𝚰),по кратным-мезомерный(𝜧).Электронное смещение происходит под влиянием заместителей,ими могут быть соседние атомы,молекулы,группы атомов,то есть радикалы.
Индуктивный эффект
Это эффект смещения электронной плотности по простым связям (𝝈-связи) из-за разности электроотрицательности атомов образующих ковалентную полярную связь(условие проявления этого эффекта) ,в результате электронная плотность смещается к более эо(электроотрицательному) атому(или радикалу). Это приводит к образованию на атомах частичных зарядов.Атом, притягивающий электронную пару к себе(электроноакцептор), приобретает частичный отрицательный заряд (-𝜹-дельта) и проявляет -𝚰 эффект, а атом, от которого смещаются электроны(электронодонор), получает частичный положительный заряд (+𝝳-дельта) и проявляет +𝚰 эффект.Индуктивный эффект атома водорода принят равным нулю.
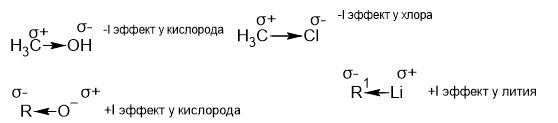
Комментарий:
Кислород и хлор более эо,чем углерод и перетягивают электронную плотность к себе являясь электроноакцепторами,но в случае с кислородом ,на котором уже сосредоточен отрицательный заряд ситуация будет обратная,так как у кислорода уже избыток электронов и он будет стремиться их отдать,т.е. он будет являться электродонором.Литий является менее эо,чем углерод и является электродонором.
Электроны соседних простых связей тоже будут смещаться в сторону более эо заместителя,но с удалением от заместителя эффект для соседних 𝝈-связей будет затухать (почти перестанет проявляться на 3-4 атоме ).Смещение электронов (электронной плотности) 𝝈-связи обозначается прямой стрелкой.

Прогнозирование свойств молекул с 𝚰-эффект
Смещение электронной плотности влияет на химические свойства частицы ,рассмотрим на примерах кислотно-основных свойств.
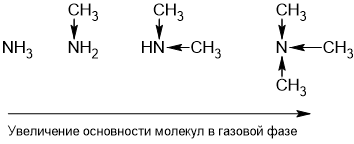
Комментарий:
На этой картинке атом азота более эо ,он перетягивает отрицательный заряд на себя,тем самым становясь акцептором для атома водорода.Протон H+ имеет свободную орбиталь,ему для устойчивости нужны электроны,которыми обладает азот(у него неподеленная пара электронов).В ряду возрастания основности азот от заместителей получает больший частичный отрицательный заряд(он не становится ионом!) и ему легче притянуть протон для взаимодействия и легче в последующем его удержать .
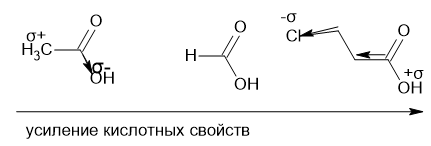
Комментарий:
На этой картинке атом кислорода более эо элемент чем углерод,поэтому проявляет -I эффект ,тем самым обретая частичный отрицательный заряд от заместителя и сильнее удерживая водород ,поэтому проявляет меньшие кислотные свойства в ряду.Атом хлора более эо ,чем атом углерода и в этом случае он будет перетягивать электронную плотность от заместителей на себя и приобретать частичный отрицательный заряд,а кислород приобретает частичный положительный заряд и будет меньше удерживать водород,поэтому будет легче отдавать протон.
Мезомерный эффект
Это эффект смещения электронной плотности по кратным связям из-за взаимодействия 𝝅-связей друг с другом или с негибридной p-связью другого атома.Для этого р-орбитали должны находиться в одной плоскости(быть параллельны друг другу) и разделяться не более чем одной сигма связью для большего перекрывания.
Молекулы ,содержащие две и более чередующиеся кратные связи,разделенные между собой одной простой связью называют сопряженной 𝝅-системой.Электроны двойных или тройных связей обладают высокой подвижностью, так как расположены дальше от ядер атомов, чем электроны 𝝈-связей, и поэтому испытывают меньшее притяжение.
Этот эффект почти не затухает.Знак «+» или «-» мезомерного эффекта определяют по заряду, появившемуся на заместителе при этом эффекте.
Электроноакцепторные заместители являются более эо и смещают электронный заряд к себе по перекрывающимся р-орбиталям или системе сопряженных 𝝅-связей, проявляя (-𝜧)-эффект. .Электронодонорные заместители смещают заряд от себя к более эо заместителю.(+𝜧)-эффект.
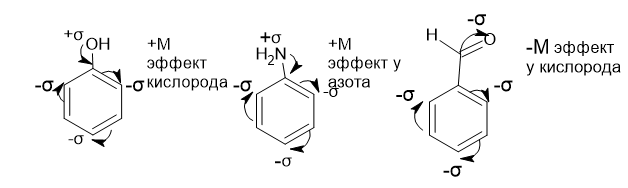
Комментарий:
В первых двух молекулах сопряженная система 𝝅-связей перетягивает на себя электронную плотность,в третьей молекуле сопряженная система не перетягивает электронную плотность на себя от кислорода,так как атом кислорода не близко связан с ней,а через С-С связь.
Часто мезомерный и индуктивный эффект встречаются в одной молекуле совместно,но обычно мезомерный эффект сильнее выражен.Также существуют молекулы,в которых,наоборот, индуктивный эффект превалирует(преобладает),они как правило реже встречаются.
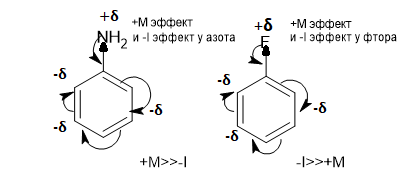
Комментарий:
В первом случае преобладает +М эффект азота,так как эо азота и углерода не сильно различны,значение индуктивного эффекта будет менее значимо.Во втором случае уже значения эо фтора и углерода значительны,что делает вклад -I эффекта фтора большим,даже не смотря на сильную подвижность электронной плотности по сопряженным кратным связям,именно это обычно обусловливает больший вклад мезомерного эффекта,чем индуктивного.
Графически смещение электронов указывают изогнутыми стрелками. Начало стрелки указывает, какие электроны смещаются при мезомерном эффекте, а конец стрелки — к какому из атомов или к какой связи.
Прогнозирование свойств молекул с 𝜧-эффектом
Особую роль электронные эффекты имеют в ароматических углеводородах,они определяют продукты реакции замещения в бензольном кольце и кислотно-основные свойства заместителей.
Заместители 1 рода смещают электронную плотность в бензольное кольцо(+М эффект),преимущественно в пара и орто положения ,в эти положения будет происходить реакция электрофильного замещения
Заместители 2 рода смещают электронную плотность с бензольного кольца к себе (-М эффект),тем самым уменьшая электронную плотность в орто и пара положениях,поэтому реакция электрофильного замещения будет происходит в мета-положения
| Заместители 1 рода (+М эффект) | Заместители 2 рода (-М эффект) |
| насыщенные группы(-ОН;-NH2;-R;-CH3;)галогены;анионы ,алкильные радикалы | ненасыщенные группы(-COOH;-COH;-CO;-NO2 и т.д.),катионы |
*насыщенные = предельные или одинарные
*ненасыщенные = непредельные или кратные
По ссылке можно скачать инфографику по данной теме
Можно проверить свои знания ниже тестированием по данной теме