Соли — это сложные вещества, состоящие из катионов и анионов. В качестве катионов могут выступать ионы металлов или ион аммония NH4+ . Анионами же могут быть кислотные остатки, комплексные частицы или комбинация кислотных остатков и гидроксо-групп.

Классификация солей
В зависимости от состава соли можно разделить на несколько групп.

Если рассматривать соли в качестве продуктов замещения, то их можно разделить на 3 группы: средние, кислые и основные.
Средние соли образуются при полном замещении ионов водорода в кислоте катионами металла. Такие соли содержат только катионы металла и кислотный остаток.
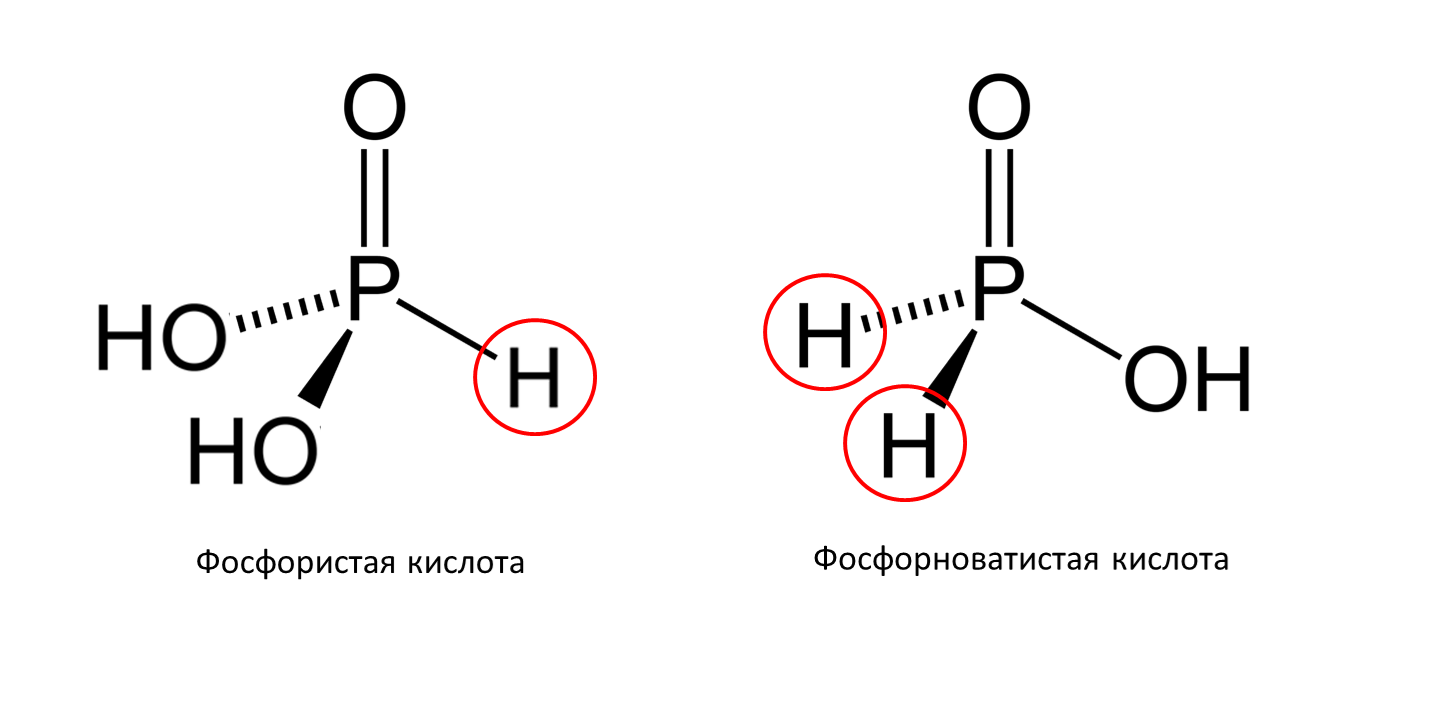
Кислые соли получаются при неполном замещении H+. В их составе присутствуют как ионы водорода, так и катионы металлов. В названии таких солей присутствует приставка «гидро -» . Например, гидрокарбонат натрия (NaHCO3 ).Важно помнить, что фосфиты (K2HPO3) и гипофосфиты (KH2PO2) являются средними солями, несмотря на то, что в их составе содержатся атомы водорода. У данных кислот в составе есть атомы водорода, которые связаны напрямую с атомом фосфора прочный связью, и не могут быть ионизированы. Поэтому фосфористая кислота двухосновная, а фосфорноватистая — одноосновная!
Основные соли являются результатом неполного замещения гидроксид ионов на кислотные остатки, поэтому в их составе находятся OH— группы. Основной солью является, например, гидроксокарбонат меди (II) ((CuOH)2CO3)
По наличию разных типов ионов соли делят на двойные и смешанные. Двойные соли образованы двумя металлами и одной кислотой (KNaCO3 ), а смешанные — одним металлом и двумя кислотами (СuBrCl). Двойные и смешанные соли получаются при совместной кристаллизации нескольких солей, поэтому данный термин применим только к солям в чистом виде. В растворе мы считаем, что находится смесь двух разных солей.
В отдельную группу выделяют комплексные соли — соли, содержащие комплексные ионы.
Примеры комплексных солей:
K3[Fe(CN)6] — гексацианоферрат калия (III) или красная кровяная соль
Na[Al(OH)4] — тетрагидроксоалюминат натрия
Na[Zn(OH)4] — тетрагидроксоцинкат натрия
[Cu(NH3)4]SO4 — сульфат тетраамминмеди (II)
Правила составления формул солей
Чтобы правильно составить формулу соли, необходимо помнить, что сумма зарядов катионов должна быть равна сумме зарядов анионов.
Название соли составляют по следующей схеме:
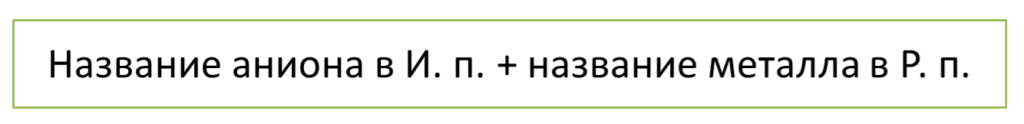
Если металл катиона имеет переменную валентность, то её указывают в скобках римскими цифрами.
В названия кислых и основных солей добавляют приставки “гидро-” и “гидроксо-” соответственно. Если кислота может образовывать несколько кислых солей, то в названии соли необходимо указать количество атомов водорода. Так, для фосфорной кислоты существует гидрофосфат (HPO42-) и дигидрофосфат ((H2PO4—).
Примеры:
MgSO4 — сульфат магния
CuCl2 — xлорид меди (II)
(CuOH)2CO3 — карбонат гидроксомеди (II)
NH4H2PO4 — дигидрофосфат аммония
Получение солей
Соли могут быть получены во многих химических процессах, рассмотрим основные их них.
1.Реакция между металлом и неметаллом
2Fe + 3Cl2 = 2FeCl3
2.Взаимодействие между металлом и кислотой-неокислителем
Металл способен вытеснять водород из кислоты, если он стоит левее водорода в ряду напряжения металлов.
Zn + 2HCl = ZnCl2 + H2↑
3.Взаимодействие металлов с щелочами
С щелочами могут взаимодействовать металлы, способные проявлять кислотные свойства (Al, Zn, Fe и др.)
2Al + 6NaOH(тв.) = 2NaAlO2 + 2Na2O + 3H2↑
2Al + 2NaOH(раств.) + 6H2O = 2Na[Al(OH)4] + 3H2↑
4.Реакция между оксидами
a) Основный оксид + кислотный оксид
CaO + SO2 = CaSO3
b) Основный оксид + амфотерный оксид
Fe2O3 + 6HNO3(разб.) = 2Fe(NO3)3 + 3H2O
5.Основный/амфотерный оксид + кислота-неокислитель
Fe2O3 + 6HNO3(разб.) = 2Fe(NO3)3 + 3H2O
6.Основание + кислотный оксид
a) Сильное основание + любой кислотный оксид
2NaOH + CO2 = Na2CO3
NaOH + CO2(изб.) = NaHCO3
b) Нерастворимое основание +кислотный оксид сильной кислоты
Cu(OH)2 + SO3 = CuSO4 + H2O
Cu(OH)2 + CO2 ≠
7.Реакция нейтрализации
Реакцией нейтрализации называют взаимодействие между кислотой и основанием, в результате которого образуется соль и вода.
KOH + CH3COOH = CH3COOK+H2O
8. Реакции обмена между другими солями
Новая соль образуется если выполняются условия проведения реакции ионного обмена (см. “Основные химические реакции с участием солей п.2”)
AgNO3 + KI = AgI↓ + KNO3
Основные химические реакции с участием солей
1.Реакции замещения
Реакция такого типа протекает если замещающий металл находится левее в ряду активности металлов, чем металл, входящий в состав исходной соли.
Zn + CuSO4 = ZnSO4 + Cu
Hg+Na2SO4⇏реакция не идёт

2.Реакции ионного обмена
Реакция ионного обмена протекает если в ходе реакции образуется осадок, выделяется газ или образуется малодиссоциирующий электролит (например вода).
NaOH + NH4Cl = NaCl + NH3 ↑+ H2O
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Zn(CH3COO)2+2HBr = ZnBr2 + 2CH3COOH
Более подробно о реакциях ионного обмена можно узнать тут.
3.ОВР
Некоторые соли могут быть участниками окислительно — восстановительных процессов. К типичным окислителям можно отнести перманганаты (KMnO4), дихроматы (K2Cr2O7), перхлораты (NH4ClO4) и др. Восстановительными свойствами обладают такие соли, как сульфиды (ZnS), галогениды (KI, NaBr), соли двухвалентного железа (FeSO4), трехвалентного хрома (Cr(NO3)3) и др. Некоторые соли могут проявлять окислительно-восстановительную двойственность, например сульфиты (Na2SO3).
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
6NaI + K2Cr2O7 + 7H2SO4 → 3Na2SO4 + 3I2 + Cr2(SO4)3 + K2SO4 + 7H2O
4.Комплексообразование
Некоторые соли способны участвовать в образовании комплексов. Комплексная частица образуется за счет образования ковалентной связи между центральным атомом и лигандами по донорно-акцепторному механизму. Центральный атом предоставляет свободные атомные орбитали, а лиганды — электронные пары.
Cu(NO3)2 + 4NH3 = [Cu(NH3)4](NO3)2
2NaF + SiF4 = Na2[SiF6]
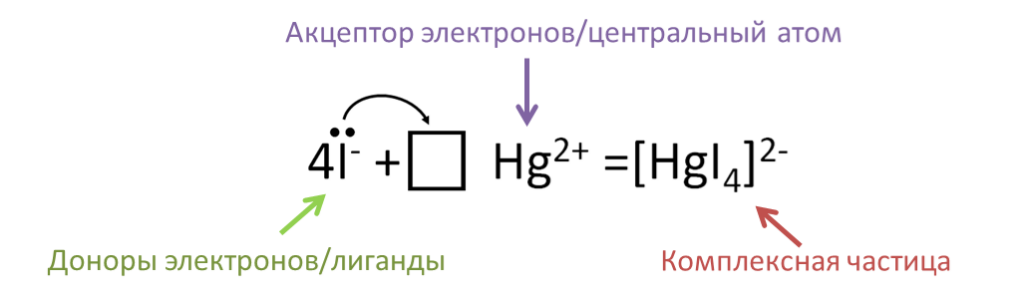
2KI + HgI2 = K2[HgI4]
В последней реакции атом ртути является центральным атомом, у него есть свободные атомные орбитали, и он может быть акцептором электронов. Атомы йода являются донорами электронов и выступают в роли лигандов . Данные атомы образуют комплексную частицу путем образования ковалентных связей. Ионы калия в свою очередь являются внешнесферными и связаны с комплексной частицей ионной связью.
5. Взаимодействие кислых солей с щелочами
Кислые соли взаимодействуют с щелочами с образованием средних солей
NaHSO4 + NaOH = Na2SO4 + H2O
KHCO3 + KOH → K2CO3 + H2O
2NaHCO3 + Ca(OH)2 = Na2CO3 + CaCO3 ↓+ 2H2O
В данной реакции гидрокарбонат ионы в присутствии щелочи образуют карбонат ионы, которые взаимодействуют с катионами натрия и кальция одновременно. Кислые соли реагируют с любыми щелочами, в том числе теми, которые образованы другим металлом.
6.Взаимодействие основных солей с кислотами
Аналогично, основные соли взаимодействуют с сильными кислотами с образованием средних солей.
Zn(OH)Cl + HCl = ZnCl2 + H2O
Основные соли также могут взаимодействовать с сильными кислотами с другим кислотным остатком, в результате образуются средние соли.
Mg(OH)2CO3 + 2HNO3 = Mg(NO3)2 + CO2 ↑+ H2O
2Cu(OH)Cl+2HBr = CuCl2 + CuBr2 + 2H2O
7.Термическое разложение
(см. тему “Разложение солей”)
8.Гидролиз
(см. тему “Гидролиз солей в водном растворе”)
Для лучшего запоминания основных химических свойств солей мы подготовили удобную памятку, которую можно найти перейдя по ссылке:
Скачать памятку основные свойства солей
Чтобы лучше усвоить данный материал предлагаем вам пройти проверочный тест:




