Сложные эфиры – производные карбоновых кислот, в которых атом водорода в гидроксильной группе замещен углеводородным радикалом. Предельные сложные эфиры имеют общую формулу в виде CnH2nO2.
Существуют два способа, позволяющие назвать сложные эфиры.
- По систематической номенклатуре. В этом случае к названию кислоты, где вместо окончания «-овая кислота» используют суффикс «-оат», в качестве приставки прибавляется название спиртового радикала.

Сложный эфир также можно назвать путем прибавления к названию аниона кислоты приставки с названием углеводородного радикала.


- По тривиальной номенклатуре. Здесь же для названий сложных эфиров используют четыре слова. Они образованы от названий кислот и спиртов, входящих в состав молекулы, с добавлением слова «эфир».

Для сложных эфиров характерны следующие виды изомерии:
- Изомерия углеродного скелета при наличии у радикала кислоты или радикала спирта не менее трех атомов углерода.
C6H12O2

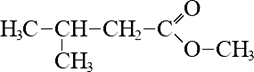
- Изомерия положения функциональной группы возможна, если в молекуле содержится не менее четырех атомов углерода.
C4H8O2


- Межклассовая изомерия, которая определяется общей формулой органических соединений. Так, изомерами сложных эфиров являются карбоновые кислоты, имеющие такое же количество атомов углерода в молекуле.
C3H6O2


Физические свойства сложных эфиров зависят от молекулярной массы вещества. Так, сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие жидкости, плохо растворимые в воде и хорошо – в органических растворителях. Большинство этих соединений имеют приятный запах, напоминающий запах фруктов. Они дают разнообразный спектр фруктовых запахов. В разбавленном растворе пентилбутанат имеет запах груш, а этилбунатант – ананасов. Сложные эфиры высших карбоновых кислот представляют собой твердые бесцветные воскообразные вещества без запаха.
Как правило, температура кипения сложных эфиров ниже, чем у соответствующих карбоновых кислот. Это объясняется отсутствием у сложных эфиров межмолекулярных водородных связей. Следовательно, сложные эфиры обладают меньшей силой межмолекулярного взаимодействия, чем соответствующие им карбоновые кислоты.
Как же получают сложные эфиры?
- В лаборатории эти вещества можно получить путем этерификации, т.е. взаимодействием карбоновых кислот со спиртами.

Эта реакция обратима, т.е. при взаимодействии с водой, сложный эфир начинает распадаться на исходные вещества. Чтобы сместить равновесие в сторону образования сложного эфира, в систему добавляют серную кислоту для связывания воды.
- Взаимодействие галогеноалканов с солями карбоновых кислот. В этом случае образуются сложный эфир и неорганическая соль (галоген-ион соединяется с ионом металла).

- Алкоголиз ангидридов. Алкоголиз — обменное разложение веществ при взаимодействии со спиртами. В результате реакции водород от спирта присоединяется к мостиковому кислороду, и образуется карбоновая кислота. А то, что осталось от спирта соединяется с углеродом с образованием сложного эфира.

Рассмотрим химические свойства.
- Отличительной чертой сложных эфиров является способность к гидролизу. Причем гидролиз может протекать как в кислой, так и в щелочной среде.
1) В кислой среде происходит процесс, обратный этерификации, называемый переэтерификацией. Сложные эфиры расщепляются под действием воды, и образуются карбоновая кислота и спирт.

Этот процесс также обратим, т.к. продукты реакции взаимодействуют между собой с образованием исходных веществ.
2) При щелочном гидролизе (или другими словами омылении) получаются спирты и
соли карбоновых кислот.

Этот процесс необратим, так как образовавшаяся соль не взаимодействует со спиртом.
- Восстановление сложных эфиров. При взаимодействии сложных эфиров с водородом в присутствии катализатора разрывается углерод-кислородная связь карбоксильной группы. В результате реакции мы получаем два спирта, один из которых содержит столько же атомов углерода, сколько было в исходной кислоте, а второй – столько же, сколько в исходном спирте. Например, при восстановлении метилпропионата образуются два спирта – метанол и пропанол.

- Аммонолиз. Этот процесс аналогичен гидролизу. Отличием является лишь то, что к кислотному остатку присоединяется не гидроксогруппа, а аминогруппа. В результате реакции образуются амид и спирт.

- Последнее свойство, характерное для всех органических соединений, — это горение.
При полном сгорании сложных эфиров (а также многих других органических соединений) образуются углекислый газ и вода.

Сложные эфиры нашли широкое применение в жизни человека. Так, сложные эфиры низших спиртов и карбоновых кислот используются в пищевой промышленности. Благодаря наличию фруктового (или же иного, специфического) запаха их применяют в качестве ароматизатора. Сложные эфиры на основе ароматических спиртов применяются в парфюмерии в качестве отдушек (этилформиат), компонента духов (изопентилэтанат, изобутилэтанат, бутилэтанат). Сложные эфиры также используют как растворителей. Например, этилацетат и пентилэтанат применяются в качестве растворителя лаков и красок. Сложные эфиры, образованные от непредельных спиртов, способны образовывать полимеры. Например, винилацетат становится поливинилацетатом, который применяется при изготовлении искусственных кож. Сложных эфиров высших карбоновых кислот используют в качестве воска (из которых впоследствии изготавливают смазки, пропиточные составы для бумаги и кожи). Также они входят в состав лекарственных препаратов и косметических средств.




