Кислоты – сложные вещества, состоящие из катионов H+ и аниона кислотного остатка (NO3— , SO42-, Cl— и другие)
Классификация кислот
1. По содержанию кислорода:
а) кислородосодержащие (H2SO4, HNO3, HNO2 и тд);
б) бескислородные (HCl, HBr, HCN и тд).
2. По основности:
а) одноосновные (HNO3, HI, HF и тд) ИСКЛЮЧЕНИЕ H3PO2;
б) двухосновные (H2SiO3, H2SO4, H2S и тд) ИСКЛЮЧЕНИЕ H3PO3;
в) трехосновные (H3PO4).
Подробнее про исключения можно прочитать в этом конспекте
3. По силе кислот:
а) сильные:
1) бескислородные: HCl, HBr, HI;
2) кислородосодержащие: HXЭОy где y-x ≥ 2.
Например: H2Cr2O7
6-2=4 ≥ 2, значит кислота сильная
Мы считаем только концевые атомы кислорода, в данной кислоте 1 атом кислорода является мостиковым, его мы не учитываем при подсчете
б) слабые:
1) бескислородные: HCN, HF, H2S;
2) кислородосодержащие: HXЭОy где y-x < 2 ИСКЛЮЧЕНИЕ H3PO3.
Например: HClO2
2-1=-1 < 2, значит кислота слабая
Также как и основания, сильные кислоты в растворе диссоциируют полностью и их диссоциацию можно написать в одну стадию:
H2SO4 = 2H+ + SO42-
А слабые кислоты почти не диссоциируют, их диссоциацию мы расписываем по ступеням:
H3PO4 = H+ + H2PO4—
H2PO4— = H+ + HPO42-
HPO42- = H+ + PO43-
(в РИО не расписываем слабую кислоту на ионы, даже кислотный остаток кислых солей)
Получение кислот
1. Кислотный оксид + вода (кислота должна быть растворимой)
SO3 + H2O = H2SO4
2NO2 + H2O = HNO3 + HNO2 !
2. Соль 1 + кислота 1 = соль 2 + кислота 2, сильная кислота должна вытеснять слабую или должен выпадать осадок/выделяться газ
CaCO3 + HCl = CaCl2 + CO2↑ + H2O
2NaNO2 + H2SO4 = Na2SO4 + 2HNO2
3. Из простых веществ (кислоты из двух элементов)
H2 + Cl2 = 2HCl
H2 + S = H2S
4. В ОВР
P + 5HNO3 = H3PO4 + 5NO2↑ + H2O
4NO2 + 2H2O + O2 = 4HNO3
Химические свойства
1. Взаимодействие с основными оксидами:
2HCl + CaO = CaCl2 + H2O
2. Взаимодействие с основаниями:
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O
3. Взаимодействие сильной кислоты с амфотерными оксидами:
ZnO + H2SO4 = ZnSO4+ H2O
4. Взаимодействие сильной кислоты с амфотерными гидроксидами:
2Al(OH)3 + 6HCl = AlCl3 + 3H2O
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты
5. Взаимодействие с металлами стоящих в ряду активности до H2
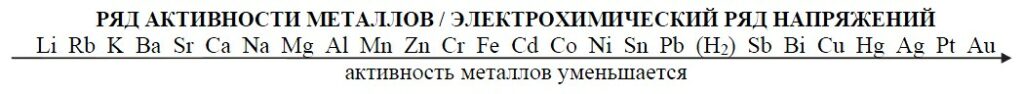
Fe + 2HCl = FeCl2 +H2↑
6. Разложение
а) самопроизвольноe:
H2CO3 = СO2↑ + H2O
H2SO3 = SO2↑ + H2O
Такие кислоты являются нестабильными веществами и существуют лишь в малых концентрациях в растворе. В растворе они находятся в равновесии со своими оксидами – углекислым газом и сернистым газом соответственно, причем равновесие сильно смещено вправо
б) при нагревании:
H2SiO3 = SiO2↓ + H2O
2HI = H2↑ + Cl2↑
2HIO3 = I2O5↓ + H2O
4HNO3 = O2↑ + 2H2O + 4NO2↑
8HClO3 = 4HClO4 + 3O2↑ + 2Cl2↑ + 2H2O.




