Термодинамика. Основные понятия
Термодинамика как наука появилась в середине 19 столетия. Тогда целью термодинамики было установление взаимосвязи между работой и теплотой, а также разработка теории паровой машины. В дальнейшем цели термодинамики значительно расширяются и все ее основные законы и положения стали широко применяются в различных областях науки особенно в химии.
Термодинамика – раздел физики, изучающий способы передачи энергии, путём взаимного превращения теплоты и работы.
В классической термодинамике изучаются свойства макроскопических систем в целом, а отдельные частицы не рассматриваются.
Макроскопическая система – это система, состоящая из большого количества частиц (молекул, атомов, ионов), поведение которых можно описать законами статистики и теории вероятности.
Термодинамика базируется на трех законах, из которых путем логических умозаключений можно получить остальные положения данной науки. Как было сказано ранее термодинамика базируется на двух постулатах и трёх законах (началах), которые не выводятся теоретически, а представляют собой следствия, обобщающие опыт человека.
В данном конспекте мы рассмотрим лишь первый закон термодинамики, его применение, а также некоторую часть других положений.
Для понимания последующего материала рассмотрим ряд наиболее основных понятий и терминов.
Системы
Под термодинамической системой тело или группа тел, мысленно выделяемые из окружающей среды.
Термодинамические системы подразделяются на:
- гомогенные системы, в которых все физические и химические свойства во всех частях системы одинаковы. Например, чистая вода или раствор поваренной соли в воде, воздух.
- гетерогенные системы, состоящие из разнородных тел, отделенных друг от друга видимыми поверхностями раздела. Примерами гетерогенных систем служат: насыщенный раствор с осадком, смесь воды и бензина, вода с песком.
Фаза – гомогенная часть гетерогенной системы.
Виды систем
- Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией. Такая система характеризуется постоянством внутренней энергией и объема (U=const, V=const).
- Закрытая система – не обменивается веществом с окружающей средой, но энергообмен возможен (V=const).
- Открытая система, способная обмениваться веществом и энергией с внешней средой.
Процессы
- Самопроизвольные – происходят без затраты энергии;
- Несамопроизвольные – происходят только при затрате энергии;
- Равновесными (квазистатическими) называются процессы, в которых система под действием бесконечно малых воздействий переходит из одного равновесного состояния в другое настолько медленно, что все промежуточные состояния можно рассматривать как равновесные. Равновесные процессы протекают бесконечно медленно, поэтому их ещё называют квазистатическими процессами.
- Обратимые – когда переход системы из одного состояния в другое происходит через последовательность одних и тех же состояний, и после возвращения в исходное состояние в окружающей среде не остается никаких изменений;
- Необратимые – процессы, в результате которых невозможно возвратить систему и всё её окружение в исходное состояние.
Параметры
Термодинамические параметры – величины, характеризующие термодинамическое состояние системы и выражающие свойства больших групп молекул.
Исходные положения термодинамики
Первый из постулатов, лежащих в основе термодинамики говорит:
Любая изолированная система с течением времени переходит в равновесное состояние и не может самопроизвольно из нее выйти.
Второй постулат термодинамики (закон термического равновесия):
Всякая равновесная система характеризуется температурой — физической величиной, описывающей внутреннее состояние этой системы. Если каждая из двух термодинамических систем находятся в тепловом равновесии с третьей, то они находятся в тепловом равновесии с друг с другом.
Внутренняя энергия. Работа и теплота
С точки зрения молекулярно-кинетической теории внутренняя энергия – это суммарная энергия макроскопического тела. А именно сумма кинетических энергий беспорядочного движения всех частиц тела и потенциальных энергий взаимодействия всех частиц друг с другом.
U = Uпост + Uвращ + Uколеб + Uядер + Uе̄̄
Внутренняя энергия зависит от природы вещества, температуры и количества вещества.
Вычислить абсолютное значение внутренней энергии невозможно, поскольку невозможно учесть движение всех частиц и их взаимное положение из-за огромного числа молекул в макроскопических телах. Но можно рассчитать её изменение их первого закона термодинамики, определяя тепловой эффект и совершенную работу.
Внутренняя энергия является функцией состояния. То есть ее изменение не зависит от пути перехода из состояния 1 в состояние 2.
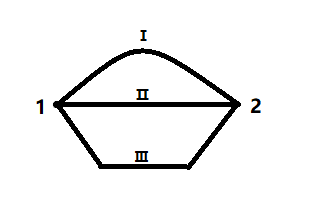
∆UI = ∆UII = ∆UIII
Теплота – это форма передачи энергии путем излучения или теплопроводности, т.е. путем хаотических столкновений молекул двух соприкасающихся тел.
Работа – передача энергии путем перемещения массы или заряда под действием каких-либо внешних сил, либо против внешних сил. Например, расширение или сжатие газа, поднятие тела в поле тяжести Земли, электрическая работа и др.
Работу, совершаемую системой или внешними силами над системой, будем обозначать W.
Легко показать, что совершаемая системой работа W при расширении или сжатии газа равна:
W = p∆V
где p – давление газа; ∆V = V2 – V 1 – изменение объема газа.
Первый закон термодинамики
Первый закон термодинамики непосредственно связан, а точнее является частным случаем закона сохранения энергии, распространенный на тепловые явления. Он позволяет рассчитать тепловые равновесия различных процессов, в том числе и химических реакций, что для нас химиков особенно интересно.
В 1844 – 1854 гг. Д. Джоуль провел опыт, в результате которого установил эквивалентность теплоты и механической работы в циклических процессах.
Результат опыта Джоуля можно записать так:
∮ δQ = ∮ δW (1)
Qцикл = Wцикл (2)
Если рассмотреть нециклический процесс (например, половину опыта Джоуля):
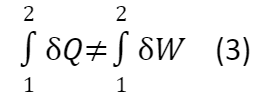
δQ ≠ δW (4)
Обозначив разность элементарной теплоты и работы как dU, получим запись первого закона термодинамики в виде бесконечно малых изменений величин:
dU = δQ — δW (5)
Проинтегрировав выражение (5), для нециклического процесса получим:
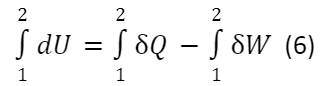
∆U = Q -W (7)
Выражение (7) — это запись первого закона термодинамики в интегральной форме.
Формулировки Первого закона
Существует множество формулировок первого закона. Вот несколько из них:
- Невозможно создать машину, которая совершала бы работу без затрата эквивалентного количества другого вида энергии. Или что тоже самое вечный двигатель первого рода невозможен.
- Энергия не создается и не разрушается, при всех процессах суммарная энергия изолированной системы остаётся постоянной.
- Количество теплоты сообщенное системе идет на изменение внутренней энергии системы и на совершение работы газом против внешних сил.
Применение первого закона термодинамики к различным процессам
С помощью первого закона термодинамики можно делать важные заключения о характере протекающих процессов.
Процессы, в которых участвует система, могут протекать при различных условиях. Рассмотрим такие процессы, в которых система представляет собой идеальный газ.
1. Расширение идеального газа в пустоте (вакуум)
Вначале газ находится в сосуде с перегородкой, в одной части которого находится вакуум, а в другой идеальный газ. Когда мы убираем перегородку, газ будет расширяться и в конечном итоге займёт всё пространство сосуда.
В этом процессе изменяется как объем, так и давление. При этом объем увеличивается, а давление уменьшается.
Опыт показывает, что Q=0, работа не совершается, а температура системы не меняется.
Работа равна нулю, так как газ расширяется в вакуум, а, следовательно, внешних сил нет.
Так для идеального газа справедливо:
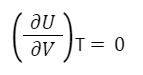
Таким образом, внутренняя энергия идеального газа зависит только от температуры и не зависит от объема и давления. Это связано с отсутствием межмолекулярного взаимодействия.
2. Изохорное нагревание
При изохорном процессе объем системы остается постоянным.
В данном процессе газ находится под недвижимым поршнем. И если газу подводить теплоту Q газ начнет нагреваться, а давление в сосуде увеличивается.
V=const
dU = δQ — δW
dU = δQ — pdV
Поскольку объём не изменяется, работа не совершается, и получаем, что
dU = δQ
∆U = Qv
В этом процессе вся теплота расходуется на повышение внутренней энергии.
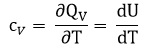
где сV – теплоёмкость вещества при постоянном объеме.
Для данного процесса справедливо выражение:
3. Изотермическое расширение
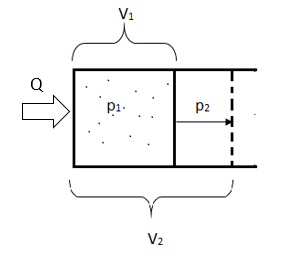
В данном опыте в некотором цилиндре, закрытом поршнем, способным двигаться без трения, находится идеального газ. Если к газу подводить тепло Q, то он будет расширяться от V1 до V2.
Передача теплоты при T=const от одного тела к другому является квазистатическим процессом. Для идеального газа (а также и для реального при небольших давлениях) внутренняя энергия зависит только от температуры. Отсюда при изотермическом процессе U=const, а изменение внутренней энергии равно нулю.
dU = δQ — δW
δQ = δW
QT = W
Используя уравнение Менделеева-Клапейрона:
pV = nRT
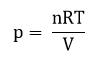
Получаем:
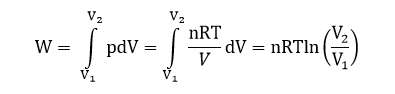
В этом процессе вся подведенная теплота идет на совершение работы расширения.
Для данного процесса справедливо выражение:
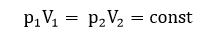
4. Изобарное нагревание
К газу, находящемуся под постоянным давлением, подводится количество теплоты Q. Газ в начале находящийся при температуре T1 занимающий объём V1 расширяется до V2 и нагревается до T2 при этом давление остаётся постоянным.
p=const
dU = δQ — δW
δQ = dU + pdV
QT = ∆U + p∆V
В этом процессе вся подведенная теплота расходуется как на нагревание, так и на расширение.
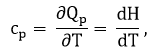
где cp — теплоёмкость вещества при постоянном давлении; H – энтальпия.
Следует отметить, что для всех веществ cp > cV , а для идеального газа справедливо:
cp = cV + R
Для данного процесса справедливо выражение:
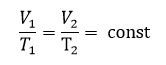
5. Адиабатическое расширение
Данный процесс осуществляется без подвода теплоты, если первоначально газ сжат и находится в термически изолированном сосуде. Здесь газ расширяется и охлаждается при условии p1>p2.
В этом процессе работа осуществляется за счет убыли внутренней энергии газа.
Q = 0
dU = δQ — δW
dU = -δW
∆U = -W
Из показанного ранее выражения cV = dU/dT следует, что dU = cVdT. И получаем:
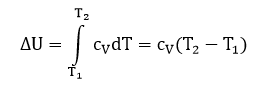
Полученное выражение справедливо для 1 моль вещества. Для несколько молей, получаем:
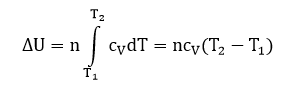
Выражение для работы расширения при адиабатическом процессе:
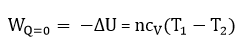
Для данного процесса справедливы выражения:
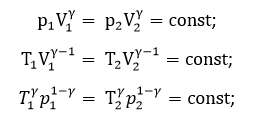
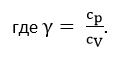
Формулы, выведенные для всех изопроцессов, справедливы и для обратных процессов.




