Ковалентные связи
Ковалентная связь — связь, образующаяся между атомами, у которых одинаковая или мало отличающаяся электроотрицательность, за счет образования общей электронной пары.
Как известно электроны в атомах находятся на орбиталях, а они в свою очередь могут иметь различную форму:
- s-орбитали (сферическая форма)
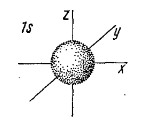
- p-орбитали (гантелеобразная форма)
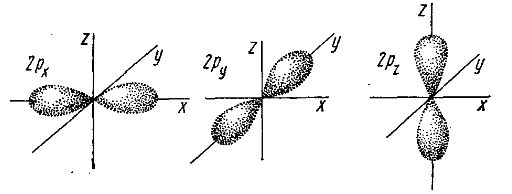
- d-орбитали

В случае образования связи (образование общей электронной пары), происходит перекрывание орбиталей, которое может происходить различным образом, в виду этого также выделяют:
- σ- связи – образуются при перекрывании орбиталей так, что область перекрывания пересекается линией, соединяющей ядра
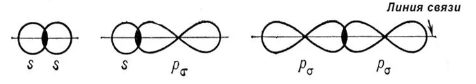
- π- связи – образуются при перекрывании орбиталей, в двух областях (над и под линией соединяющей ядра атомов)
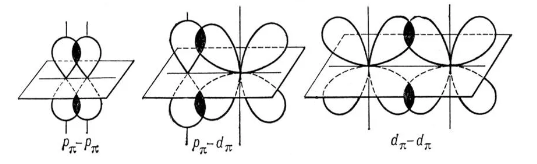
В зависимости от количества образованных общих электронных пар (кратности связи) разделяют:
- Простые (одинарные) – являются σ- связью
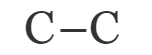
- Двойные – образована из одной σ- и одной π- связи
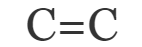
- Тройные – образована из одной σ- и двух π- связи
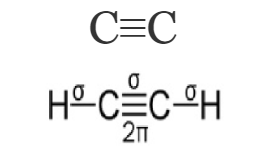
Максимальная валентность атома С равна 4!
Валентность — количество химических связей, которые образует атом, или число атомов, которое может присоединить или заместить атом данного элемента.
Существует два типа обозначения ковалентной связи:
- Чертой
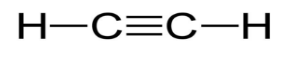
- Точками (электронами)
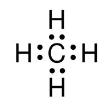
Разделяют два механизма образования ковалентной связи:
- Обменный механизм – связь образуется за счет предоставления одного электрона от каждого атома
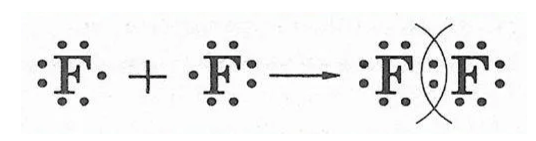
- Донорно-акцепторный – связь, образованная между донором и акцептором
Донор — это атом или ион, который предоставляет неподеленную электронную пару.
Акцептор — атом, предоставляющий вакантную орбиталь.

Донорно-Акцепторный тип связи встречается в соединениях:
- Соли аммония
- Соли фосфония
- Угарный газ {CO}
- Азотная кислота
- Комплексные соединения
В зависимости от элементов образующих ковалентную связь выделяют:
- Неполярные связи – связь, в которой общая пара электронов равноудалена от атомных ядер и одинаково принадлежит обоим атомам.
Данная связь наблюдается, когда электроотрицательность атомов, образующих связь, одинакова. Это говорит о том, что атомы равноценно стягиваю электронную плотность, в результате вероятность нахождения (плотность вероятности) электронов сосредоточена точно между двумя атомами.
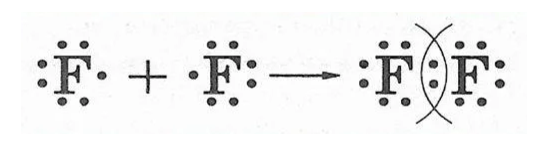
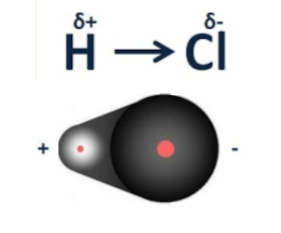
- Полярные связи – связь, электронный обмен между двумя атомами в молекуле вещества, при котором общая пара электронов смещается к одному атому.
Данная связь наблюдается, когда электроотрицательность атомов, образующих связей, неодинакова. Данное различие в электроотрицательности приводит к смещению электронной плотности к более электроотрицательному. Следует учесть, что разница в электроотрицательности не должна быть сильно большой, чтобы не происходило образование ионов.
Такая связь встречается только в связях между атомами неметаллов разной природы!
Смещение плотности к одному из атомов, приводит к деформации молекулы, которая становится диполем. Край, в котором лежит более электроотрицательный атом, обладает отрицательным зарядом, а сам атом частично отрицательны, что обозначается как δ—. Соответственно для более электроположительного атома δ+, а край положительный.
Смещение плотности к одному из атомов обозначается →, направленной к тому атому, к которому она смещается.
Химические свойства ковалентной связи
Качественные свойства:
- Направленность
- Насыщаемость
- Поляризуемость
- Полярность
Направленность связи – определяет молекулярное строение веществ и геометрическую форму их молекул. Если в молекуле больше двух атомов, то между двумя связями выделяется угол, называемый валентным.
Насыщаемость связи – способность атомов образовывать ограниченное число ковалентных связей. Данное ограничение фиксируется числом вакантных орбиталей.
Поляризуемость связи – смещение электронов в данной связи под действием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они расположены от ядер.
Полярность связи – неравномерное распределение электронной плотности вследствие различия электроотрицательности атомов. Данное свойство, критерий полярной и неполярной связи.
Все вышеперечисленные свойства определяют реакционную способность молекул, однако из них только поляризуемость и полярность определяют реакционную способность по отношению к полярным реагентам.
Количественные характеристики:
- Энергия связи
- Длина связи
- Дипольный момент
Энергия связи – энергия, выделяющаяся при образовании связи, или необходимая для ее разрушения. Энергия связи характеризует прочность данной связи.
Единицы измерения: Ε [кДж/моль]
Длина связи – расстояние между центрами связанных атомов. Чем больше длина связи, тем она менее прочная и наоборот.
Единицы измерения: L [нм]; [Å]
Нанометр нм=10-9м
Ангстрем Å=10-10м
Дипольный момент – векторная величина, характеризующая полярность связи.
Единицы измерения: (Дебай) D=3,4 Кл*м
Физические свойства ковалентной связи
- Низкие температуры плавления и кипения
- Летучие
- Электрический ток плохо проходит через эти соединения, поэтому они плохие проводники тока, следовательно, хорошие изоляторы
- Соединения типа углеводороды; сульфиды, галогениды, оксиды неметаллов под действием тепла могут загораться
Ионные связи
Ионная связь — связь, возникающая в результате электростатического притяжения катионов и анионов.
Катион — положительно заряженный ион (молекула или атом).
Характеризуется величиной положительного электрического заряда.
Анион — отрицательно заряженный ион (молекула или атом). Отрицательный заряд обусловлен избытком электронов по сравнению с количеством протонов.
Образование данных ионов обусловлено значительной разницей в электроотрицательностях. Как было озвучено в ковалентной связи, важно знать граничный переход между ковалентной и ионной связью.
Так ионная вязь будет образовываться если разница в электроотрицательностях >2!
Большая разница э.о. говорит, о сильном смещении электронной плотности к одному атому, вследствие чего возникает электростатическое взаимодействие между атомами (молекулами) образующих данную связь, однако важно учитывать, что полного перехода электрона к атому не происходит!

Разница в электроотрицательностях данного примера: F(4,0)- Na(0,93)=3,07
Данное значение больше 2, поэтому мы можем смело сказать, что связь ионная.
Ионная связь в большинстве случаев проявляется в связях между атомами разной природы, в которых выделяют металлы и неметаллы. Однако возможно проявление связи между атомом и группой атомов, в роли которых могут выступать кислотные остатки, а атомом в данного случае будет какой-то металл.
Химические свойства ионной связи
Качественные свойства:
- Ненаправленность
- Ненасыщаемость
Ненаправленность – заключается в представлении иона как заряженного шара, который может притягивать ион противоположного знака по любому направлению.
Ненасыщаемость – проявляется в том, что взаимодействие с ионом противоположного заряда не приводит к полной компенсации силовых полей, в результате чего способность притягивать ионы по другим направлениям сохраняется.
Количественные свойства:
- Энергия связи
- Длина связи
- Дипольный момент
Физические свойства:
- Нелетучие
- Тугоплавкие
- Твердые
- Диссоциация в воде (растворимость)
- Проводят электрический ток (в растворе и расплаве)
Металлическая связь
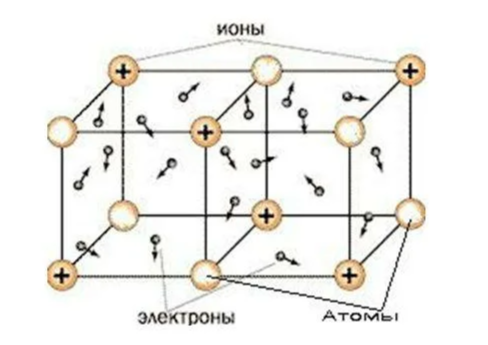
Металлическая связь — это связь между положительными ионами металлов и общими электронами, которые свободно движутся по всему объёму.
Металлическая связь наблюдается в металлах, где он существует в виде кристалла, с металлической кристаллической решёткой, в узлах которой находятся ядра металлов. Электроны же свободно летают между этих узлов.
Металлическая связь рассматривается с точки зрения теории электронного газа:
- Частичная ионизация атомов с образованием катионов происходит из-за того, что электроны атомов металлов слабо связаны с ядром. Поэтому, в узлах кристаллической решетки металла могут находиться как нейтральные атомы, так и катионы металла.
- Ионизация приводит к тому, что в объеме металла формируется так называемый электронный газ, представляющий собой совокупность слабосвязанных с ионами электронов, перемещающихся в пространстве между узлами кристаллической решетки. Электронный газ подчиняется кинетической теории газов. Атомы, ионы и электроны представляют собой твердые сферы, которые движутся по прямым линиям до столкновения друг с другом.
- Вдоль любой оси кристалл металла представляет собой чередующиеся области положительного (катионы в узлах решетки) и отрицательного заряда (облака электронного газа). Поэтому металлическая связь не направлена. Взаимодействие между электронами и ионами обеспечивает стабильность системы в целом.
В металлической связи в основном рассматриваются физические свойства, так как химические свойства, это свойства самого металла.
Физические свойства металлической связи
- Электропроводность
- Теплопроводность
- Металлический блеск и непрозрачность металлов
- Пластичность
- Повышенные температуры плавления
Электропроводность — наличие в системе электронного газа позволяет существование направленного движения электронов под действием внешнего электрического поля. Поэтому все металлы обладают высокой электропроводностью.
Теплопроводность — перенос тепловой энергии происходит как за счет перемещающихся по системе электронов, так и за счет колеблющихся ионов, способных передавать кинетическую энергию соседним ионам, что говорит о высокой теплопроводности. Данное свойство позволяет применять соединения с данной связью, например, в качестве материала радиаторов.
Металлический блеск и непрозрачность металлов — объясняется тем, что пространство между узлами кристаллической решетки занято движущимся электронным газом, поэтому попадающие кванты света упруго взаимодействуют с потоком электронов и отражаются от поверхности металла.
Пластичность – объясняется тем, что механическое воздействие на металл, слои атомов и ионы смещаются относительно друг друга, что вызывает перераспределение атомов (ионов) и электронного газа в пространстве, однако при этом не происходит разрушения кристалла. Пластичность является отличительным свойством многих металлов, благодаря этому некоторые из них могут быть прокатаны в тонкие листы и вытянуты в проволоку.
Водородные связи
Водородная связь – связь между положительно заряженным атомом водорода с сильноотрицательными элементами. Чаще всего рассматривается N,O,Cl,F.

Ковалентные связи H–O, H–F, H–N, H–Cl являются сильно полярными, так как на атоме водорода образуется избыточный положительный заряд, а на противоположных атомах – избыточный отрицательный заряд. Между разноименно заряженными краями возникают силы электростатического притяжения – водородные связи.
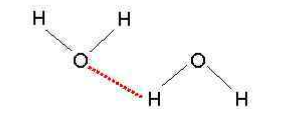
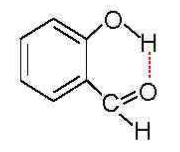
Различают водородные связи:
- межмолекулярными
- внутримолекулярными
Энергия водородной связи примерно в десять раз меньше энергии обычной ковалентной связи, но тем не менее водородные связи играют большую роль во многих физико-химических и биологических процессах.
Характеристики водородной связи:
- Направленность
- Насыщаемость
Влияние водородной связи на физические свойства соединения:
- Увеличение температуры кипения и плавления
Присутствие водородной связи добавляет дополнительную энергию связывания молекул, хоть и небольшую, однако ее достаточно, чтобы привести к аномальному изменению температуры кипения и плавления, а именно к их увеличению.
Водородная связь оказывает большое влияние на свойства многих веществ, особенно в биологических системах. Например, водородная связь определяет довольно некомпактную упаковку молекул воды во льду, поэтому плотность льда меньше плотности жидкой воды.




