Прежде чем приступить к освоению нового материала, необходимо вспомнить информацию, полученную ранее, так как без неё будет сложно понять то, о чём пойдёт речь далее. Для этого можно почитать о классификации неорганических соединений вот отсюда.
Следует ответить на вопросы:
- Что такое оксиды?
- Что такое гидроксиды?
- Какова классификация оксидов и гидроксидов?
Для эффективного повторения предлагается сделать небольшое задание.
Распределить предложенные соединения по группам.
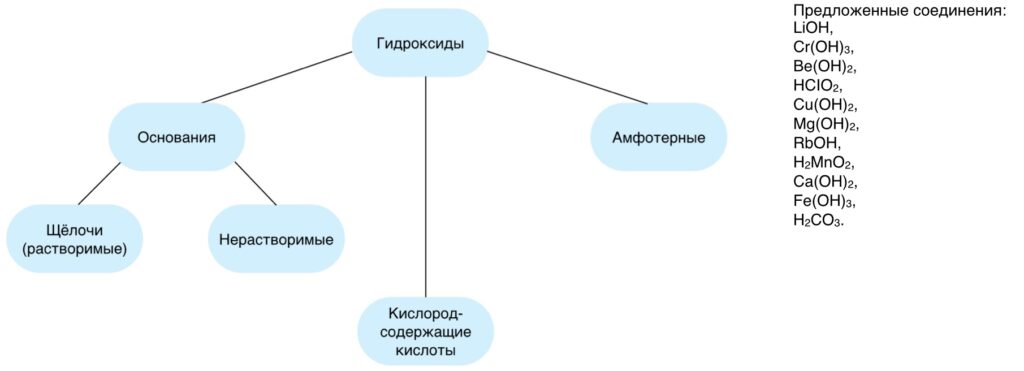
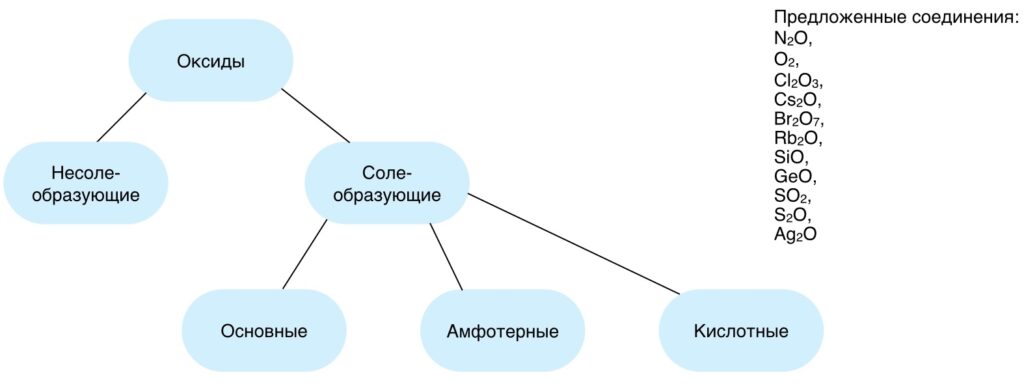
Если на вопросы ответы были даны без особых затруднений то при выполнении задания возможны ошибки, в силу отсутствия соответствующих знаний об амфотерных соединениях, чтобы выяснить почему некоторые вещества относят к амфотерным, приступим к рассмотрению нашей темы.
1. Понятие «амфотерность»
Амфотерность – способность некоторых химических веществ и соединений проявлять как кислотные, так и основные свойства.
Амфотерные соединения – вещества, которые в зависимости от условий реагируют и с кислотами, и со щелочами.
2. Определение
Для того чтобы определить является ли данный оксид или гидроксид амфотерным можно воспользоваться неким правилом:
Амфотерные оксиды и гидроксиды образуют металлы в степени окисления +3, +4
Примерами могут являться:Cr2O3,Fe2O3,SnO2,MnO2,As2O3,Al2O3,Cr(OH)3, Fe(OH)3,Al(OH)3.
Следует обратить внимание на то, что есть исключения. Металлы Be,Zn,Ge,Sn,Pb образуют соединения, в которых проявляют степень окисления +2. Однако, эти оксиды и гидроксиды демонстрируют амфотерные свойства.
Примеры: BeO, SnO, PbO, Be(OH)2, Sn(OH)2, Pb(OH)2.
То есть, амфотерный характер носят оксиды и гидроксиды большинства переходных элементов и многих элементов побочных подгрупп.
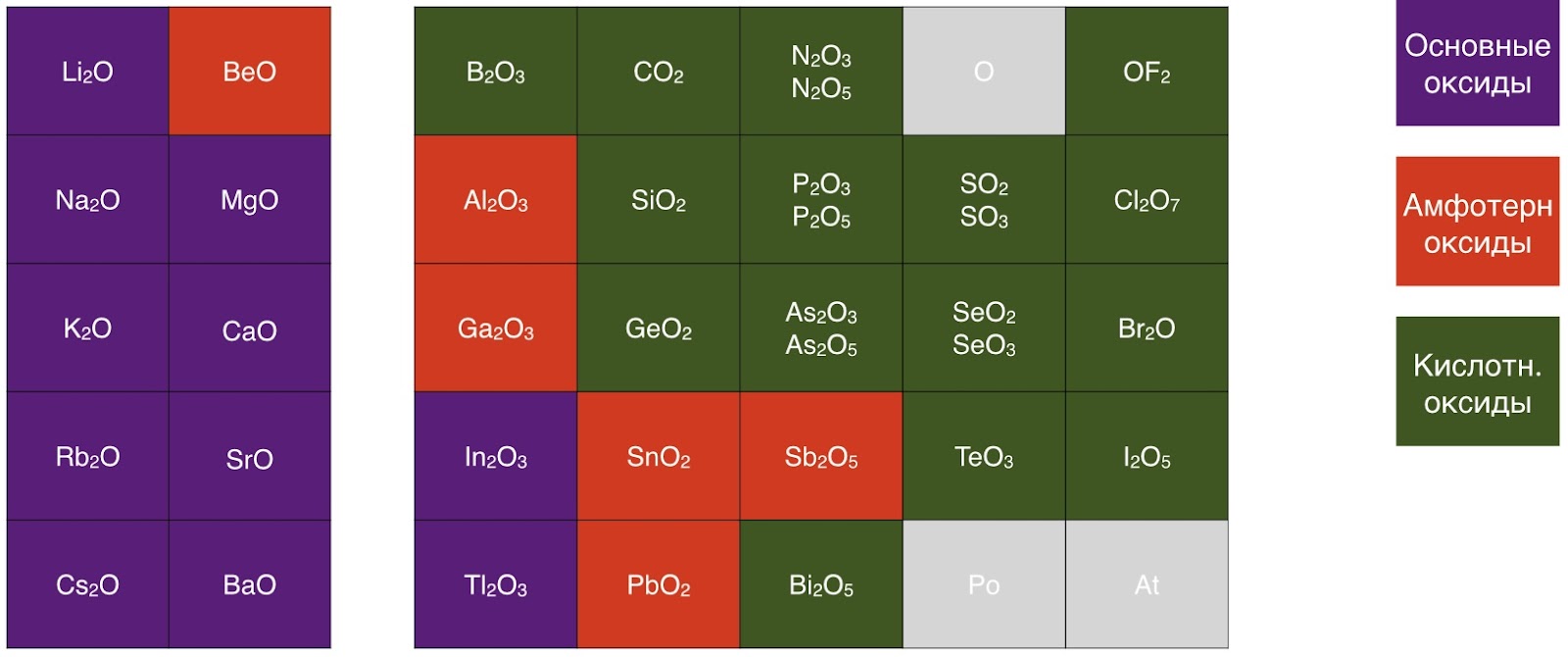
3. Физические свойства
Среди амфотерных оксидов при обычных условиях нет ни газов, ни жидкостей, все они являются твёрдыми веществами. Они нерастворимы или малорастворимы в воде и некоторые обладают характерной окраской (SnO — тёмно-синий, GeO — коричнево-чёрный, PbO — красный, жёлтый или оранжевый).
Большинство оксидов устойчивы к нагреванию, вследствие высокой термической устойчивости, которая обусловлена их строением.Если рассматривать Al2O3, то атомы кислорода образуют кубическую плонтоупакованную структуру. Атомы металла расположены в пустотах структуры. В зависимости от условий получения получают оксиды Al2O3 различного строения. Наиболее устойчивая модификация — α-Al2O3 -корунд. Соединение с такой структурой обладает высокой прочностью и твёрдостью. Если рассмотреть Cr2O3, то он обладает ромбоэдрической структурой типа α-Al2O3 -корунд. Вследствие чего можно сделать вывод, что данное соединение будет термически устойчивым. Обобщёно говоря, термическая устойчивость обусловлена строением амфотерных оксидов.
Амфотерные гидроксиды – твёрдые кристаллические вещества, плохо растворимые в воде. Как правило, они имеют белый цвет, но одно соединение имеет отличную от белой окраску (Cr(OH)3 – серо-зелёный).
4.Химические свойства
Оксиды:
- Не взаимодействуют с водой;
- Взаимодействуют с кислотами;
- Взаимодействуют с кислотными оксидами;
- Взаимодействуют с основными оксидами (только щелочными и щелочноземельными);
- Взаимодействуют с щелочами;
- Взаимодействуют с солями.
Гидроксиды:
- Реагируют с кислотами;
- Реагируют с кислотными оксидами;
- Реагируют с щелочами;
- Реагируют с основными оксидами;
- Реагируют с солями;
- Разлагаются при нагревании.
5. Правила по написанию химических реакций
1. Амфотерный оксид + H2O ≠
2. Амфотерные оксиды (гидроксиды) проявляют свойства основных оксидов (оснований) в реакции с кислотами.
Амфотерный оксид (амфотерный гидроксид) + кислота = соль + H2O
Примеры:
ZnO + 2HCl=ZnCl2 + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Al2O3 + 3H2SO4= Al2(SO4)3 + 3H2O
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Как правило, амфотерные оксиды взаимодействуют с сильными и средними по силе кислотами
Степень диссоциации кислоты определяет её силу, про диссоциацию можно почитать здесь.
Амфотерные гидроксиды металлов в степени окисления +3, не реагируют с такими кислотами как, H2S, H2SO3,H2CO3
Из-за того, что соли, которые образовывались бы в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты.
3.Амфотерные оксиды (гидроксиды) проявляют основность при реакции с кислотными оксидами.
Амфотерный оксид (амфотерный гидроксид) + кислотный оксид →t,°C соль (+H2O)
Реакция идёт при нагревании, не идёт такая реакция с SO2 и CO2.Реакция идёт с участием высших оксидов, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5)
Примеры:
ZnO + SO3 = ZnSO4
(Zn(OH)2+SO3 = ZnSO4 + H2O)
BeO + N2O5 = Be(NO3)2
(Be(OH)2 + N2O5 = Be(NO3)2 + H2O)
CO2 реагирует с нерастворимыми амфотерными гидроксидами (в степени окисления +2), а также с Cu(OH)2 в виде суспензий в воде с образованием основных солей.
2Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O).
4. Амфотерные оксиды (гидроксиды) проявляют (кислотные) свойства кислотных оксидов в реакциях с основными оксидами (только щелочными и щелочноземельными)
Амфотерный оксид (амфотерный гидроксид) + основный оксид = соль
Реакция осуществима как в растворах, так и при сплавлении.
| а) В растворах | б) При сплавлении |
| Основные оксиды в воде сразу переходят в щёлочи и амфотерные оксиды (гидроксиды) реагируют с ними. | — |
| Раствор → комплексная соль | Расплав →t,°C средняя соль (+H2O) |
| Cr2O3 + 3BaO +6H2O = Ba3[Cr(OH)6]2 3BaO + 2Cr(OH)3 + 3H2O = Ba3[Cr(OH)6]2 | Fe2O3 + Cs2O = 2CsFeO2 BaO + 2Cr(OH)3 = Ba(CrO2)2 + 3H2O |
Амфотерные гидроксиды при сплавлении реагируют только с оксидами щелочных и щелочноземельных металлов
5. Амфотерные оксиды (гидроксиды) проявляют (кислотные) свойства кислотных оксидов при взаимодействии с щелочами.
Амфотерный оксид (амфотерный гидроксид) + основание = соль
Реакция осуществима как в растворах, так и при сплавлении.
| а) В растворах | б) При сплавлении |
| Раствор → комплексная соль | Расплав →t,°C средняя соль+ H2O |
| ZnO + Ca(OH)2 + H2O = Ca[Zn(OH)4] Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Be(OH)2 + Ba(OH)2 = Ba[Be(OH)4] Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] | PbO + 2LiOH = Li2PbO2 + H2O ZnO + 2NaOH = Na2ZnO2 + H2O Zn(OH)2 + 2LiOH = Li2ZnO2 |
Лишь 2 амфотерных гидроксида Fe(OH)3 и Cr(OH)3 растворяются только в концентрированных растворах щелочей.
Общая схема:
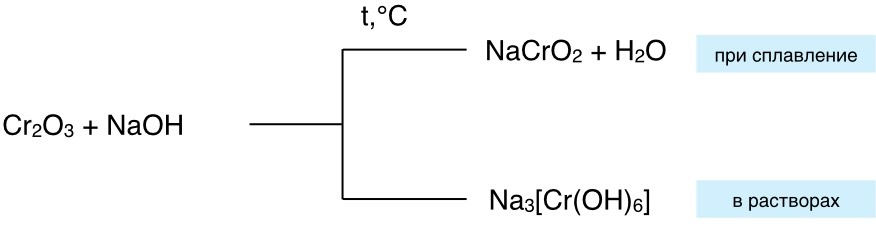
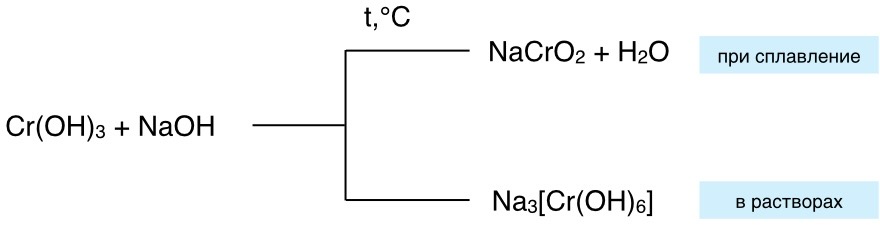
6. Амфотерные оксиды способны при сплавлении с некоторыми солями вытеснять летучие оксиды.
Амфотерный оксид + соль (карбонаты/сульфиты) = CO2/SO2 + средняя соль
Пример:
BaCO3 + Al2O3 = CO2 + Ba(AlO2)2
Амфотерные гидроксиды взаимодействуют с солями, образованными щелочным металлом и анионом, с которым «амфотерный металл» не может образовать существующую или устойчивую соль, происходит гидролиз этой соли и появление щелочной реакции раствора
Примеры:
Al(OH)3 + Na2S + H2O = Na[Al(OH)4] + NaHS
Cr(OH)3 + Na2SO3 + H2O = Na[Cr(OH)4] + NaHSO3
7. Амфотерные гидроксиды разлагаются при нагревании.
Амфотерный гидроксид → оксид + H2O
Примеры:
2Fe(OH)3 = Fe2O3 + 3H2O
6. Получение
Получение амфотерных оксидов:
1.Термическое разложение амфотерных гидроксидов:
Zn(OH)2 → ZnO + H2O
2.Прямое взаимодействие металла с кислородом:
2Be + O2 = 2BeO
Таким способом не получают оксид железа II, т.к при окислении железа образуется Fe3O4
3. Термическое разложение нитратов:
4Cr(NO3)2 = 2Cr2O3 + 8NO2 ↑ + O2 ↑
4.Окисление оксидов с более низкой степенью окисления:
CrO + O2 = Cr2O3
Получение амфотерных гидроксидов:
Прибегают к различным способам получения, т.к растворением соответствующего оксида в воде амфотерный гидроксид получить нельзя, из-за маленькой растворимости оксидов.
1. Действием раствором щёлочи на растворимую соль, содержащую амфотерный металл:
AlCl3 + 3NaOH = Al(OH)3 ↓ + 3NaCl
В этих реакциях не используются концентрированные растворы щёлочи и большие избытки этих растворов, т.к образуются комплексные соединения
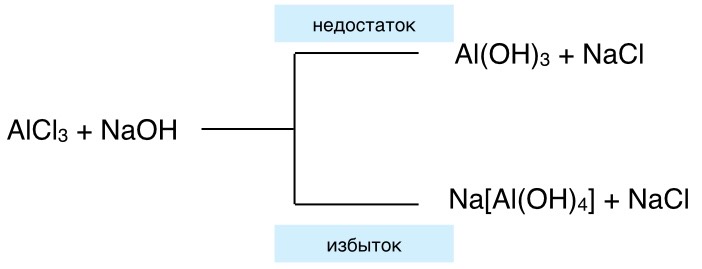
2.Действием аммиака на раствор соли, содержащей амфотерный металл:
ZnBr2 + 2NH3 + 2H2O = Zn(OH)2↓ + 2NH4Br
3.Действием на раствор соли, содержащей амфотерный металл, растворов солей с таким анионом, который не будет образовывать существующих солей с амфотерным металлом (или соли гидролизуются):
AlCl3 + Na2SiO3 + H2O = Al(OH)3 + NaCl + H2SiO3 ↓
4.Действием разбавленных кислот на гидроксокомплексы:
K3[Fe(OH)6] + 3HBr = 3KBr + 3H2O + Fe(OH)3↓
При добавлении избытка происходит образование двух солей.
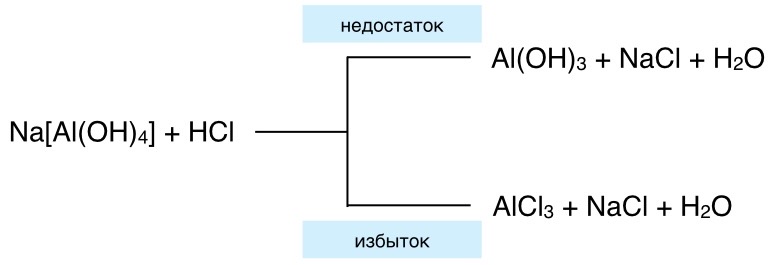
5.Действием газа ( CO2, Cl2, HCl) на гидроксоалюминаты, гидроксоферриты и гидроксохромиты, гидроксобериллаты, цинкаты:
2Na3[Cr(OH)6] + 3CO2 = 3Na2CO3 + 2Cr(OH)3↓ + 3H2O
2Na[Al(OH)4] +Cl2 = NaClO + 2Al(OH)3↓+ NaCl + H2O
Памятку по химическим свойствам оксидов и гидроксидов можно скачать по ссылке.
Чтобы закрепить теоретический материал по данной теме, можно пройти тест:
Загрузка…