Общие сведения о карбоновых кислотах:
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH.
Строение карбоксильной группы:
Карбоксильная группа содержит две функциональные группы — карбонильную -C=O и гидроксильную -OH, которые оказывают взаимное влияние друг на друга:
— В карбонильной группе атом углерода несет частичный положительный заряд и стягивает на себя неподеленную электронную пару атома кислорода гидроксильной группы.
— Смещение электронной плотности к карбонильному атому кислорода вызывает дополнительную поляризацию связи O-H, что облегчает отщепление протона (обусловливает кислотные свойства):
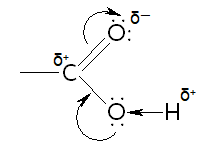
-OH группа уменьшает положительный заряд на карбонильной группе, что приводит к ослаблению способности к реакциям нуклеофильного замещения (см. химические свойства). На степень диссоциации карбоновых кислот оказывает влияние природа углеводородного радикала. По мере увеличения его размера кислотность уменьшается, но незначительно, так как индуктивный эффект быстро затухает по цепи. Введение к карбоксильной группе электроноакцепторных заместителей увеличивает силу карбоновых кислот, особенно в орто-положении к карбоксильной группе.
Классификация карбоновых кислот:
По числу карбоксильных групп:
- Одноосновные карбоновые кислоты — имеют одну карбоксильную группу -СООН. Общая формула CnH2n+1COOH или CnH2nO2.
- Многоосновные карбоновые кислоты — имеют две и более карбоксильные группы -СООН.
По строению углеводородного скелета:
- Предельные карбоновые кислоты – карбоксильная группа -СООН соединена с предельным радикалом. Например, этановая кислота: СН3–СООН.
- Непредельные карбоновые кислоты – карбоксильная группа -СООН соединена с непредельным радикалом(содержит одну или несколько двойных/тройных связей). Например, акриловая кислота: СН2=СН–СООН.
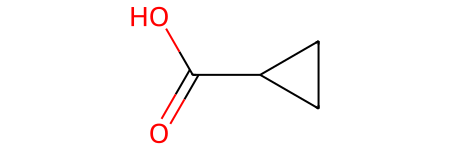
- Циклические кислоты — карбоксильная группа -СООН соединена с углеводородным циклом. Например, циклопропанкарбоновая кислота: С3Н5СООН:
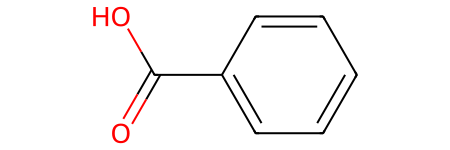
- Ароматические кислоты — карбоксильная группа -СООН соединена с непредельным радикалом, содержащим бензольное кольцо . Например, бензойная кислота: С6Н5СООН.
Номенклатура ароматических карбоновых кислот:
Ароматические карбоновые кислоты называют как производные бензойной кислоты, либо кислот других ароматических систем.
Пример:
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Бензойная | Фенилкарбоновая | Бензоат | |
| Фталевая | Бензол-1,2-дикарбоновая кислота | Фталат | |
| Изофталевая | Бензол-1,3-дикарбоновая кислота | Изофталат | |
| Терефталевая | Бензол-1,4-дикарбоновая кислота | Терефталат |
Если в состав кислоты входит более одной карбоксильной группы, название отражает это с использованием префиксов (ди-, три- и так далее).
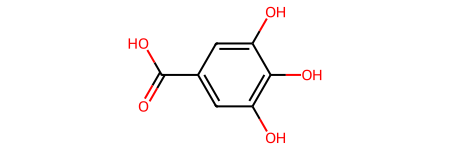
Пример: 3,4,5-тригидроксибензойная кислота.
Нумерация:
При нумерации атомов углерода в кольце ароматического соединения карбоксильная группа всегда занимает первое место. Нумерация углеродов производится так, чтобы минимизировать номера карбоксильной группы и других заместителей.
Пример: y-Изодуриловая кислота
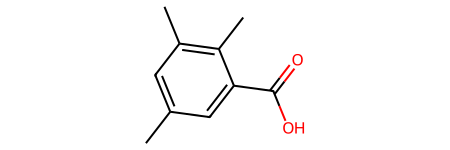
Правильное название: 2,3,5- триметилбензойная кислота
Неправильное название: 3,5,6- триметилбензойная кислота
Заместители:
Если в ароматическом кольце имеются другие заместители, они обозначаются перед названием кислоты и располагаются в алфавитном порядке.
Примеры:
2-фуранкарбоновая (пирослизевая):
4-метоксибензойная (анисовая):
3-пиридинкарбоновая (никотиновая):
Изомерия карбоновых кислот:
Ароматические карбоновые кислоты могут проявлять несколько типов изомерии, включая структурную и стереоизомерию:
Структурная изомерия:
Соединения с структурной изомерией имеют одинаковую молекулярную формулу, но различные структуры. В случае ароматических карбоновых кислот выделяют следующие типы структурной изомерии:
— Изомерия положения карбоксильной группы: Карбоксильная группа может занимать разные положения на бензольном кольце (орто-, мета- и пара-изомеры).
Примеры:
- Орто-толуоловая кислота (2-метилбензойная кислота):
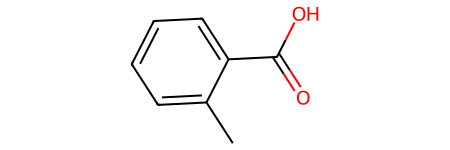
- Мета-толуоловая кислота (3-метилбензойная кислота):
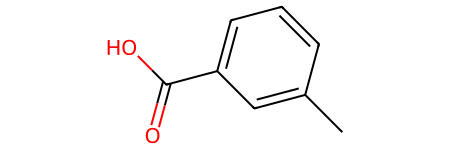
- Пара-толуоловая кислота (4-метилбензойная кислота):
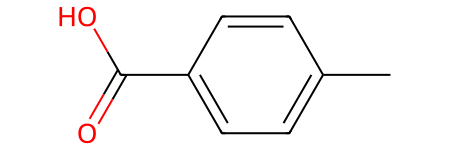
Разные изомеры могут обладать различной растворимостью, температурой плавления и кипения, а также различной реакционной способностью. Понимание изомерии важно для прогнозирования поведения этих соединений в химических процессах.
Физические свойства:
1. Состояние при комнатной температуре.
— Ароматические карбоновые кислоты (например, бензойная, салициловая кислоты) при комнатной температуре- твердые кристаллические вещества .
Это связано с тем, что ароматические кислоты могут образовывать прочные межмолекулярные водородные связи, которые способствуют созданию твердой структуры.
2. Цвет и запах
— Ароматические карбоновые кислоты имеют характерный запах.
— Некоторые кислоты, такие как бензойная, могут существовать в виде белых (и прозрачных) кристаллов.
3. Растворимость
— Низкомолекулярные карбоновые кислоты хорошо растворимы в воде благодаря образованию водородных связей с молекулами воды.
— Высокомолекулярные карбоновые кислоты менее растворимы в воде, так как увеличивающаяся углеродная цепь мешает образованию водородных связей.
— В то же время карбоновые кислоты хорошо растворимы в органических растворителях.
4. Температура кипения и плавления
— Карбоновые кислоты имеют более высокие температуры кипения и плавления по сравнению с аналогичными углеводородами и спиртами. Это объясняется наличием карбоксильной группы, которая позволяет образовывать более прочные водородные связи.
— Например, фталевая кислота имеет температуру кипения около 378 °C, тогда как 1,2-диметилциклогексан кипит при 129 °C.
Химические свойства:
Ароматические карбоновые кислоты обладают всеми свойствами алифатических кислот.
Кислотные свойства:
Ароматические карбоновые кислоты способны отщеплять протон (H⁺) из карбоксильной группы. Водные растворы ароматических карбоновых кислот обычно имеют низкое значение pH.
Реакция диссоциации:
— Ароматические карбоновые кислоты способны диссоциировать в водных растворах, образуя карбоксилат-ионы (RCOO⁻) и ионы водорода (H⁺).
Этерификация:
— Ароматические карбоновые кислоты могут реагировать с спиртами в реакциях этерификации с образованием сложных эфиров. Эта реакция обычно проходит при наличии катализатора (например, концентрированной серной кислоты) и подгоняется к обратной реакции (дегидратации).
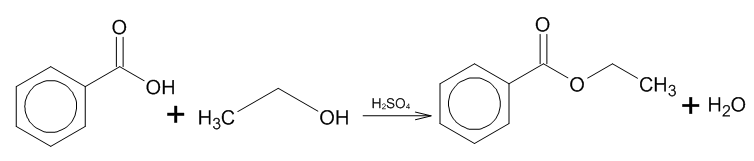
Восстановление:
— Ароматические карбоновые кислоты могут быть восстановлены до соответствующих спиртов, например, с помощью литий-алюминий гидрида (LiAlH₄).
Химическая модификация ароматического кольца:
— Ароматические карбоновые кислоты могут участвовать в реакциях электрофильного замещения на ароматическом кольце. Например, их можно подвергать хлорированию, нитрованию, сульфурированию и другим аналогичным процессам.
Из-за наличия сопряженной π-электронной системы ароматические кислоты вступают в реакции присоединения только в жестких условиях — на свету или при сильном нагревании.
Обычно электрофильное замещение включает два ключевых этапа:
— Атаку электрофила: Электрофил атакует один из π-электронов, временно нарушая ароматичность и формируя менее стабильное промежуточное состояние.
— Восстановление ароматичности: В последующем происходит отщепление протона H⁺, в результате чего ароматическая структура восстанавливается.
По характеру влияния на ароматическое кольцо, заместители можно разделить на 2 вида:
Заместители 1 рода: -OH, OR, RCOO-, SH, SR, NHR, NR2, NHCOR, -N=N-, -NH2, Alk-, Hal-. Ориентируют электрофильный реагент в орто- или пара- положения.
Заместители 2 рода: NO2—, SO3H, -COOH, -C N, -NH3+, NR3+, COR, COOR, CCl3, CHal3, -C=O. Ориентируют электрофильный реагент в мета-положение. Так как карбоксильная группа является заместителем второго рода, то в случае хлорирования бензойной кислоты в присутствии катализатора AlCl3 образуется продукт с замещением в мета- положении:
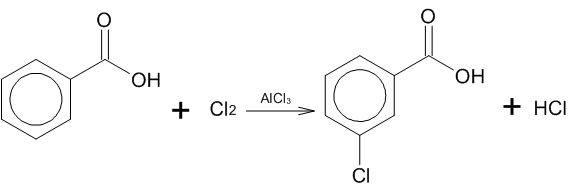
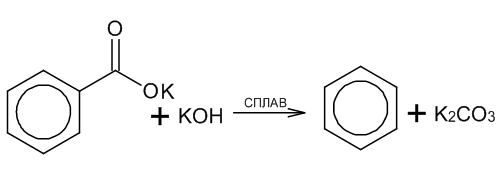
Декарбоксилирование:
-Ароматические карбоновые кислоты могут подвергаться декарбоксилированию при нагревании с щелочами, образуя соответствующие углеводороды.
Получение:
1. Окисление спиртов, алкенов и алкинов:
При окислении вышеупомянутых и некоторых других соединений подкисленным раствором перманганата калия образуются соответствующие их формулам карбоновые кислоты.
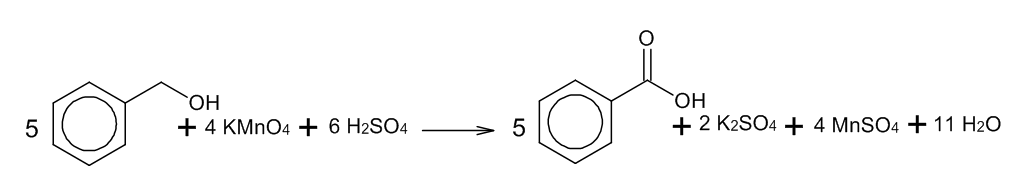
2. Окисление альдегидов:
Альдегиды реагируют с раствором перманганата или дихромата калия в кислой среде при нагревании, а также с гидроксидом меди при нагревании.
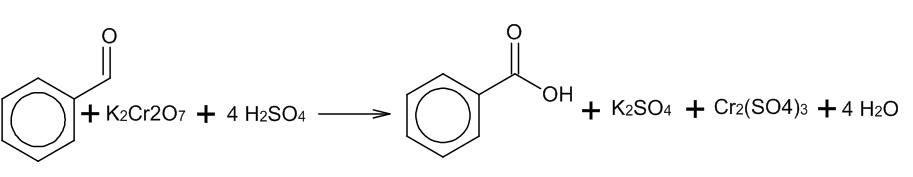
3. Получение карбоновых кислот из солей:
Карбоновые кислоты можно получить из их солей действием минеральной кислоты на раствор соли:
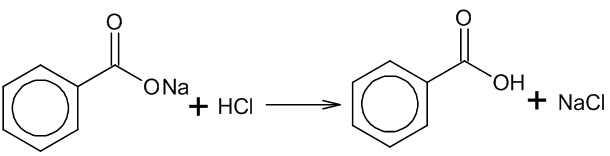
Минеральные кислоты — это неорганические химические соединения, при диссоциации которых образуются ионы водорода (H⁺).
4. Гидролиз сложных эфиров:
Сложные эфиры подвергаются гидролизу в кислой среде при нагревании:
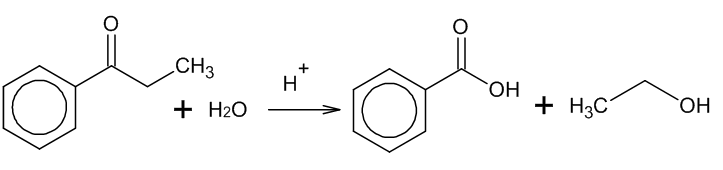
Применение:
Фармацевтика:
— Салициловая кислота используется в производстве лекарств, особенно противовоспалительных и анальгезирующих средств (например, аспирин).
— Применяется в дерматологии для лечения акне и других кожных заболеваний.
Пищевая промышленность:
— Бензойная кислота и её соли (бензоаты) используются как антисептики и консерванты для предотвращения роста микробов в продуктах питания.
Косметика и парфюмерия:
— Ароматические карбоновые кислоты могут использоваться в косметических средствах для улучшения текстуры кожи.
— Применяются в парфюмерии для создания различных ароматов.
Химическая промышленность:
— Используются как промежуточные продукты в синтезе красителей, пигментов и других химических соединений.
— Применяются в производстве полимеров и пластмасс. Пример: терефталевая кислота используется для производства синтетических волокон.
Сельское хозяйство:
— Ароматические карбоновые кислоты могут использоваться в качестве компонентов в пестицидах и гербицидах, например, кумариновая кислота.
Биотехнология:
— Применяются в производственных процессах для получения биоактивных соединений.
Можно скачать памятку по реакциям карбоновых кислот
Для закрепления прочитанной информации можно пройти тест
Выполнила Акулова Алина