ХЛОР ФТОР



г. Самара
ул. ак. Павлова, д. 1

iemn@ssau.ru
+7 (846) 334-54-04
ХЛОР ФТОР
Основания — это сложные вещества, в состав которых входит катион металла (или NH4+) и гидроксид ион (-ОН). При диссоциации в водных растворах в качестве аниона образуют только ионы ОН–.
Основания с одной группой ОН – однокислотные (например, NaOH), с двумя – двухкислотные (Ca(OH)2) и с тремя – трехкислотные (Ni(OH)3).
1. Взаимодействие основных оксидов с водой
При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое или малорастворимое основание.
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой
С водой реагируют в обычных условиях щелочные и щелочноземельные металлы. При этом протекает бурная окислительно-восстановительная реакция с образованием щелочи.
2K + 2H2O → 2KOH + H2
Если использовать металлы средней активности, то при взаимодействии с водой образуются не основания, а оксиды.
3Fe + 4H2O → Fe3O4 + 4H2
Исключение в данном случае составляет марганец. Он так же является металлом средней активности, но при взаимодействии с водой образует гидроксид.
Mn + 2H2O → Mn(OH)2 + H2
3. Электролиз растворов некоторых солей щелочных металлов
В ходе электролиза солей металлов, стоящих в ряду напряжения до алюминия, на катоде происходит восстановление воды с выделением газообразного водорода и гидроксид-ионов. Катионы металла, образованные в ходе диссоциации соли, образуют с полученными гидроксид-ионами основания. Данный метод используется преимущественно в промышленности.
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Образование оснований при взаимодействии других щелочей с солями
При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
KHCO3 + Ca(OH)2 → CaCO3 + KOH + H2O
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
1. Взаимодействие с сильными кислотами и их оксидами с образованием соли и воды
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами
4. Окисление низших неустойчивых оснований
Восстановителями в данном случае являются основания, образованные металлами с минимальной или промежуточной степенью окисления.
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
1. Отношение к индикаторам
Щелочи способны изменять окраску индикаторов:
Лакмус (фиол.) — синий
Фенолфталеин (б/ц) — малиновый
Метиловый оранжевый (оранж.) — желтый
2. Взаимодействие с кислотами с образованием средней соли и воды (реакция нейтрализации)
Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты.
Например, гидроксид натрия при взаимодействии с трехосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
Если кислота находится в избытке или мольное соотношение реагентов 1:1, то образуется дигидрофосфат:
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении веществ 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
Если щелочь находится в избытке или соотношение реагентов 3:1, то образуется фосфат:
3NaOH + H3PO4 → Na3PO4 + 3H2O
3. Взаимодействие с амфотерными оксидами и гидроксидами
Если реакция протекает в расплаве, образуются средние соли, а если в растворе — комплексные.
NaOH + Al(OH)3 (расплав) = NaAlO2 + 2H2O
NaOH + Al(OH)3 (раствор) = Na[Al(OH)4]
4. Взаимодействие с кислотными оксидами
В избытке щелочи образуется средняя соль, а в избытке кислотного оксида — кислая.
2NaOH (изб.) + CO2 = Na2CO3 + H2O
2NaOH + CO2 (изб.) = NaHCO3
5. Взаимодействие с солями
Такие реакции ионного обмена протекают в том случае, если соль растворима и наблюдается видимый признак реакции (газ, осадок).
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
При взаимодействии с щелочами соли амфотерных металлов, находящиеся в избытке, образуют амфотерные гидроксиды.
Если же в избытке щелочь, то образовавшийся гидроксид способен вступать с ней в реакцию с образованием комплексного соединения:
ZnSO4 (изб.) + 2KOH = Zn(OH)2↓ + K2SO4
ZnSO4 + 4KOH (изб.) = K2[Zn(OH)4] + K2SO4
6. Взаимодействие с кислыми солями
Возможно образование средних или менее кислых солей.
KHSO3 + KOH = K2SO3 + H2O
Ca(OH)2(изб.) + NaHCO3 → CaCO3 + NaOH + H2O
Ca(OH)2 + 2NaHCO3(изб.) → CaCO3 + Na2CO3 + 2H2O
7. Взаимодействие с металлами в растворе или расплаве
Если окислительно-восстановительная реакция проводится в растворе, то будет образовываться комплексная соль и водород, если в расплаве — средняя соль и водород.
При этом в растворе с щелочами реагируют только те металлы, у которых оксид с минимальной степенью окисления металла амфотерный.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
8. Взаимодействие с неметаллами
Щелочи взаимодействуют с большинством неметаллов, за исключением кислорода, водорода, азота, углерода и инертных газов.
В случае других неметаллов преобладают реакции диспропорционирования (самоокисления-самовосстановления):
2NaOH +Cl20 = NaCl— + NaCl+O + H2O (на холоде)
6NaOH +3Cl20 = 5NaCl— + NaCl+5O3 + 3H2O (при нагревании)
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
3I20 + 6NaOH → 5NaI— + NaI+5O3 + 3H2O
4P0 + 3NaOH +3H2O → 3NaH2P+1O2 + PH3-3
3S0 + 6NaOH → 2Na2S-2 + Na2S+4O3 + 3H2O
9. При нагревании щелочи не разлагаются
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Гидроксид натрия
Тривиальные названия — едкий натр, каустическая сода.
Используется во многих отраслях промышленности, например, при производстве целлюлозы, моющих средств, биодизельного топлива, а также в нефтепереработке.
Гидроксид калия
Тривиальное название — едкое кали.
Используется в производстве моющих средств как сырье для получения различных соединений калия, а также в качестве электролита в гальванических элементах.
Гидроксид кальция
Тривиальное название — гашеная известь, пушонка.
Гашеную известь с древних времен использовали в строительстве для приготовления скрепляющей смеси (известкового раствора). Известковое молоко применяют в производстве сахара, а также в сельском хозяйстве для борьбы с вредителями.
Гидроксид магния
Используется в промышленности в качестве наполнителя при производстве пластмасс, в медицине — как средство для уменьшения кислотности желудочного сока.
После прочтения данной темы, вы можете пройти тест по ссылке и закрепить пройденный материал.
Также, перейдя по ссылке ниже, можно скачать инфографику с химическими свойствами оснований.
Существуют качественные реакции на катионы и качественные реакции на анионы. При протекании различных реакций на тот или иной катион или анион мы можем наблюдать различные изменения, то есть эффекты реакции.
С точки зрения наблюдаемых эффектов качественные реакции можно разделить на несколько групп:
HCl + AgNO3 = HNO3 + AgCl↓ выпадение белого осадка
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑ выделение газа
ZnO↓ + 2NaOH + H2O = Na2[Zn(OH)4] растворение осадка
FeCl3+KSCN=Fe(SCN)3+KCl тёмно-красный раствор
Na2S+HNO3=H2S↑+NaNO3 выделение газа с неприятным запахом тухлых яиц
Na+ горит жёлтым цветом; Ca2+ горит кирпично-красным цветом
«Каждый катион можно обнаружить с помощью качественной реакции с использованием определённого реактива».
Рассмотрим примеры некоторых из них:
| Ион | Реактив | Реакция, эффекты реакции |
| H+ | Лакмус | Красный цвет раствора |
| Метиловый оранжевый | Розовый цвет раствора | |
| NH4+ | Раствор щёлочи, OH—, t | NH4++OH—=NH3↑+H2O Газ с резким запахом |
| Ag+ | Соляная кислота(HCl), раствор хлорида(Cl—) | Ag++Cl—=AgCl↓Белый осадок(творожистый) |
| Li+ | Пламя | Карминово-красный окрашивание |
| Na+ | Пламя | Жёлтое окрашивание |
| Ca2+ | Пламя | Кирпично-красное окрашивание |
| Раствор угольной кислоты(H2CO3) или соли карбонаты(CO32-) | Ca2++CO32-=CaCO3↓ Белый осадок | |
| Соли фосфаты(PO43-) | Ca2++PO43-=Ca3(PO4)2↓ Белый осадок | |
| Ba2+ | Пламя | Жёлто-зелёное окрашивание |
| Раствор серной кислоты(H2SO4) или соли сульфата(SO42-) | Ba2++SO42-=BaSO4↓ Белый осадок, нерастворимый в кислотах | |
| Al3+ | Раствор щёлочи, OH— | Al3++3OH—=Al(OH)3↓ Белый осадок(студенистый) |
| Cu2+ | Пламя | Зелёное окрашивание |
| Вода(H2O) | Образовавшиеся гидратированные ионы Cu2+ имеют голубую окраску | |
| Раствор щёлочи, OH— | Cu2++2OH—=Cu(OH)2↓ Голубой осадок(студенистый) | |
| Fe2+ | Раствор щёлочи, OH— | Fe2++2OH—=Fe(OH)2↓ Зелёный осадок |
| Раствор красной кровяной соли(K3[Fe(CN)6]) | K3[Fe(CN)6]+Fe2+= Тёмно-синий осадок | |
| Fe3+ | Раствор щёлочи, OH— | Fe3++2OH—=Fe(OH)3↓ Красно-бурый осадок |
| Раствор желтой кровяной соли(K4[Fe(CN)6]) | K4[Fe(CN)6]+Fe3+= Тёмно-синий осадок | |
| Раствор роданида(KSCN или NH4SCN) | Fe3++3NH4SCN=3NH4++ +Fe(SCN)3 Кроваво-красное окрашивание раствора | |
| Cr3+ | OH—(недостаток) | Cr3++OH—=Cr(OH)3↓ Грязно-голубой осадок |
| Pb2+ | Раствор сульфида(S2-) | Pb2++S2-=PbS↓ Чёрный осадок |
| Раствор иодида(I—) | Pb2++I—=PbI2↓ Жёлтый осадок | |
| Mn2+ | Раствор щёлочи, OH— | Mn2++2OH—=Mn(OH)2↓ Светло-розовый осадок |
| Раствор сульфида(S2-) | Mn2++I—=MnS↓ Красно-розовые кристаллы | |
| Раствор угольной кислоты(H2CO3) или соли карбонаты(CO32-) | Mn2++CO32-=MnCO3↓ Розовый осадок, который на воздухе становится бурым |
При выборе реагента для различения двух катионов в неорганической химии нужно ориентироваться на то, что одно вещество будет реагировать с добавленным реагентом, а второе нет. При этом должен наблюдаться какой-либо эффект реакции: выпадение осадка, выделение газа, изменение цвета,… Также вещества можно отличить друг от друга, если они оба реагируют с добавленным реагентом, но делают это по-разному.
Сравним катионы Na и Ba
Например, можно использовать соль Na2SO4, так как образуется белый осадок BaSO4. Таким образом, один катион будет образовывать нерастворимое соединение, а другой — нет.
*Кроме того, при выборе реагента для разделения ионов необходимо учитывать также pH среды, температуру и другие факторы, которые могут влиять на эффективность процесса разделения.
Теперь рассмотрим катионы NH4+ и Li+
Если посмотрим в таблицу растворимости, можно обратить внимание, что литий способен образовывать нерастворимое соединение с фосфатами — Li3PO4 . Кроме того, эти катионы можно различить и другим способом. Если добавим раствор щёлочи(KOH), то будет образовываться газ с резким запахом — аммиак(NH3). Таким образом, мы можем обнаружить любой из этих катионов.
Сравним катионы Ag+ и Mn2+
Для того, чтобы различить эти катионы, мы можем использовать Na2S. В данном случае оба катиона будут образовывать нерастворимые соединения, однако они будут разного цвета: Ag2S — чёрный осадок; MnS — розовый осадок.
Далее рассмотрим Zn2+ и Mg2+
Если посмотрим в таблицу растворимости, можно обратить внимание, что оба катиона образуют нерастворимые основания при действии на их соли раствором щёлочи. Однако, следует обратить внимание, что Zn(OH)2 является амфотерным гидроксидом и при действи избытком щёлочи, он растворится с образование комплексного соединения. Поэтому останется только Mg(OH)2 — осадок белого цвета.
Сравним катионы Fe2+ Fe3+
При рассмотрении данных катионов мы также можем обратиться к таблице растворимости. Оба катиона образуют нерастворимые соединения с раствором щёлочи. Когда в реакцию с OH— вступает Fe2+, мы наблюдаем зелёный осадок, который со временем темнеет из-за окисления соединения на воздухе. Если же говорить про осадок, образующийся с Fe3+, то здесь наблюдаем бурый осадок. Кроме того, эти два катиона можно различить раствором сульфида(S2-) (Fe2+ будет образовывать чёрный осадок — FeS). Fe3+ вступает в ОВР (окислительно-восстановительную реакцию) с сульфидами. В результате образуется два осадка( FeS и S), поэтому данный реагент не совсем удобен для различия данных катионов. Также можно подействовать жёлтой или красной кровяной солью, так как жёлтая является реагентом на Fe3+, а красная — на Fe2+.
Качественные реакции в неорганической химии имеют большое значение и играют важную роль в определении химических свойств и состава различных веществ. Они используются для обнаружения химических элементов и соединений на основе их химических свойств и реакций. Кроме того, качественные реакции используются в процессе обучения и исследований неорганической химии, так как они позволяют демонстрировать различные химические процессы и законы, а также практически применять полученные знания о химических свойствах веществ.
Таблицу, представленную в конспекте, можно сохранить по ссылке
Для проверки полученных знаний вы можете пройти тест:
Качественная реакция — это химическая реакция, позволяющая точно определить ионы в веществе.
Для проведения качественной реакции используют различные реагенты. Реагент — это вещество использующееся для обнаружения ионов вещества определенного состава.
В качестве реагентов могут выступать простые вещества, комплексные соединения, сложные вещества (оксиды, гидроксиды, кислоты и соли), а также различные индикаторы (лакмус, фенолфталеин и метиловый оранжевый).
Индикаторы — это соединения, которые меняют свой цвет в зависимости от среды раствора в котором они находится.
Для разделения галогенид-ионов используют раствор нитрата серебра , который позволяет четко определить каждый анион:
Также раствор нитрата серебра можно использовать для определения фосфат-иона. Это приведет к образованию желтого осадка.
С помощью солей бария можно провести качественную реакцию по определению анионов:
Для обнаружения сульфит-иона проводят качественную реакцию с кислотой. При взаимодействии сульфита с кислотой выделяется газ с резким запахом (SO2), который можно обнаружить по изменению цвета индикаторной бумаги или по появлению запаха.
Для определения сульфид-ионов добавляют ионы свинца, которые приводят к образованию черного осадка.
Для определения нитрат-иона реакцию проводят в присутствии концентрированной серной кислоты и меди. При нагревании образуется голубой раствор и выделяется бурый газ. Реакцию обмена на выпадение осадка провести невозможно, поскольку все соли содержащие нитрат-ион хорошо растворимы в воде.
Карбонат-ион и гидроксикарбонат-ион определяют добавляя кислоту. При взаимодействии карбоната с соляной кислотой выделяется углекислый газ, который можно обнаружить по образованию пузырьков или помутнению известковой воды.
Силикат-ионы обнаруживаются при реакции солей с сильной кислотой. Например, если к силикату прилить хлоридную кислоту, то выпадает белый осадок — кремниевая кислота.
Для обнаружения гидроксид-ионов в растворе используют индикаторы. Наиболее распространённые индикаторы — лакмус, метилоранж и фенолфталеин. При добавлении этих индикаторов к раствору, содержащему гидроксид-ионы, происходит изменение окраски индикатора. Например, лакмус становится синим, метилоранж — жёлтым, а фенолфталеин — малиновым.
В разных средах продукты восстановления перманганата калия (фиолетовый раствор) могут быть разными. В кислой среде перманганат-ионы восстанавливаются до ионов Mn2+(бесцветный раствор), в нейтральной среде — до оксида марганца(IV) (бурый осадок), а в щелочной — до манганат-ионов (зелёный раствор).
При выборе реагентов для различия пар анионов важно учитывать несколько ключевых моментов:
1. Химические свойства анионов
• Изучите, какие реакции могут происходить с конкретными анионами. Например, некоторые анионы могут образовывать осадки с определёнными катионами, в то время как другие — нет.
2. Специфичность реагентов
• Используйте реагенты, которые реагируют только с одним из анионов в паре. Например, если у вас есть Cl— и Br⁻, добавление AgNO₃ приведёт к образованию осадка AgCl, но не AgBr.
3. Изменение цвета или осадка
• Многие реакции приводят к изменению цвета раствора или образованию осадка, что может служить индикатором наличия определённого аниона. Например, I⁻ даёт желтый осадок с Pb(NO₃)₂.
4. Кислотно-основные свойства
• Некоторые анионы могут вести себя как кислоты или основания. Например, CO₃²⁻ реагирует с кислотами, выделяя углекислый газ (CO₂).
5. Газообразование
• Некоторые анионы при реакции с кислотами выделяют газы, что также может быть полезным для их идентификации (например, CO₃²⁻ с HCl выделяет CO₂).
6. Сравнение свойств
• Для различия пар анионов можно использовать их химические свойства в сравнении друг с другом. Например, SO₄²⁻ и CO₃²⁻: BaCl₂ образует осадок BaSO₄, но не BaCO₃.
7. Определение по цвету
• Некоторые анионы могут образовывать окрашенные комплексы с определёнными ионами.
Пример: различие Cl⁻ и Br⁻:
• Добавьте AgNO₃: Cl⁻ образует белый осадок AgCl, Br⁻ — желтый осадок AgBr.
• Можно использовать HNO₃ для растворения AgCl (белый осадок), но AgBr остается нерастворимым.
Следуя этим принципам, вы сможете эффективно выбирать реагенты для различия анионов.
| Анион | Реагент, среда | Реакция | Признаки |
| F— | Растворимые соли Ca2+ | Ca2++F—=CaF2 | Белый осадок, растворимый в HNO3 |
| Cl— | Нитрат серебра Ag+ | Ag++Cl—=AgCl | Белый творожистый осадок, нерастворимый в H2O и HNO3 |
| Br— | Нитрат серебра Ag+ | Ag++Br—=AgBr | Бледно-желтый творожистый осадок, нерастворимый в H2O и HNO3 |
| I— | Нитрат серебра Ag+ | Ag++I—=AgI | Желтый творожистый осадок, нерастворимый в H2O и HNO3 |
| PO43- | Нитрат серебра Ag+ | Ag++PO43-=Ag3PO4 | Желтый осадок растворимый в HNO3 |
| CrO42- | Растворимые соли Ba2+ | Ba2++CrO42-=BaCrO4 | Желтый осадок, нерастворимый в CH3COOH , но растворимой в HCl |
| SO42- | Растворимые соли Ba2+ | Ba2++SO42-=BaSO4 | Белый мелкодисперсный осадок, не растворимый в H2O и HNO3 |
| SO32- | Сильная кислота H+ | 2H++SO32-=H2SO3 (SO2 и H2O) | Газ с резким запахом, обесцвечивание окислителей (Br2 и KMnO4) |
| S2- | Раствор соли Pb2+ и Cu2+ | Pb2++S2-=PbS Cu2+ +S2-=CuS | Черный осадок |
| NO3- | Медная стружка и концентрированный раствор H2SO4 при нагревании | 2NaNO3+ Cu+ 2H2SO4=2NO2+ CuSO4+ Na2SO4+2H2O | Бурый газ “Лисий хвост” и голубая окраска раствора |
CO32- | Растворимые соли Ca2+ | Ca2++CO32-= CaCO3 | Белый осадок |
| Сильная кислота H+ | 2H++CO32-=CO2+ H2O | Газ без запаха и цвета, не поддерживающий горения | |
| HCO3— | H++ HCO3—=CO2+ H2O | ||
| SiO32- | Кислота H+ | 2H+ + SiO32-=H2SiO3 | Студенистый осадок |
| OH— | Лакмус | — | Синее окрашивание |
| Фенолфталеин | Малиновое окрашивание | ||
| Метилоранж | Желтое окрашивание | ||
| MnO4— | Щелочная среда | MnO4— (OH—)=MnO42- 2MnO4—+SO32-+2OH—=2MnO2+SO42-+H2O | Зеленый раствор |
| Нейтральная среда | MnO4— (H2O)=MnO2 2MnO4—+3SO32-+H2O=2MnO2+3SO42-+2OH— | Бурый осадок. | |
| Кислая среда | MnO4— (H+)=Mn2+ 2MnO4—+6H++5SO32-=2Mn2++5SO42-+3H2O | Бесцветный раствор |
Также мы можете пользоваться таблицей растворимости кислот, солей и оснований в воде для того чтобы понять какие анионы выпадают в осадок с катионами.
Качественные реакции имеют большое значение в химии, потому что они помогают определить состав вещества и его свойства. С помощью этих реакций можно идентифицировать различные элементы, соединения и функциональные группы. Они основаны на физических и химических свойствах веществ, таких как цвет, запах, растворимость, электропроводность и другие.
Качественные реакции широко применяются в аналитической химии, криминалистике, медицине, пищевой промышленности и других областях. Например, в криминалистике для обнаружения анионов используются качественные реакции, основанные на осаждении солями бария и серебра, а также окислительно-восстановительные. Они позволяют быстро и точно определить наличие определенных веществ в образце, что может быть полезно для контроля качества продукции, диагностики заболеваний и проведения научных исследований.
Таблицу представленную в конспекте можно скачать по ссылке.
Вы можете проверить свои знания по данной теме, пройдя тест по ссылке:
Прежде чем приступить к освоению нового материала, необходимо вспомнить информацию, полученную ранее, так как без неё будет сложно понять то, о чём пойдёт речь далее. Для этого можно почитать о классификации неорганических соединений вот отсюда.
Следует ответить на вопросы:
Для эффективного повторения предлагается сделать небольшое задание.
Распределить предложенные соединения по группам.
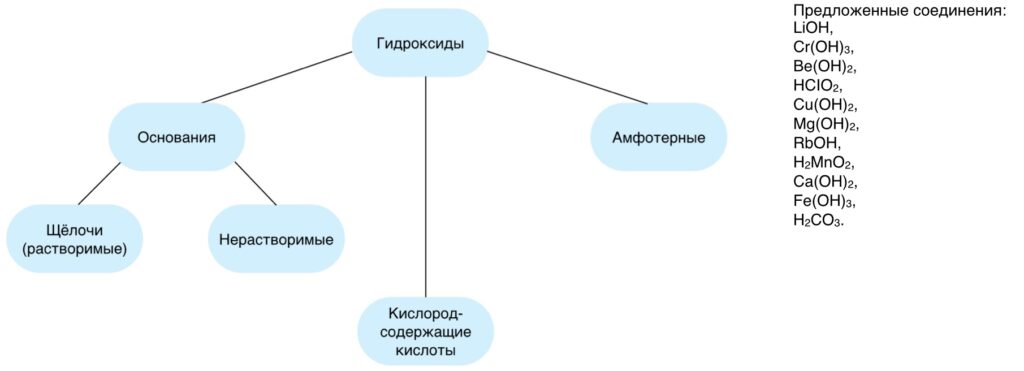
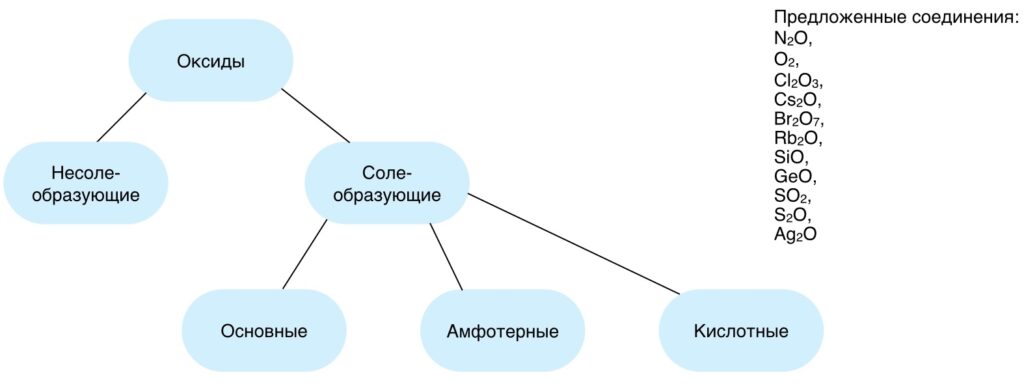
Если на вопросы ответы были даны без особых затруднений то при выполнении задания возможны ошибки, в силу отсутствия соответствующих знаний об амфотерных соединениях, чтобы выяснить почему некоторые вещества относят к амфотерным, приступим к рассмотрению нашей темы.
Амфотерность – способность некоторых химических веществ и соединений проявлять как кислотные, так и основные свойства.
Амфотерные соединения – вещества, которые в зависимости от условий реагируют и с кислотами, и со щелочами.
Для того чтобы определить является ли данный оксид или гидроксид амфотерным можно воспользоваться неким правилом:
Амфотерные оксиды и гидроксиды образуют металлы в степени окисления +3, +4
Примерами могут являться:Cr2O3,Fe2O3,SnO2,MnO2,As2O3,Al2O3,Cr(OH)3, Fe(OH)3,Al(OH)3.
Следует обратить внимание на то, что есть исключения. Металлы Be,Zn,Ge,Sn,Pb образуют соединения, в которых проявляют степень окисления +2. Однако, эти оксиды и гидроксиды демонстрируют амфотерные свойства.
Примеры: BeO, SnO, PbO, Be(OH)2, Sn(OH)2, Pb(OH)2.
То есть, амфотерный характер носят оксиды и гидроксиды большинства переходных элементов и многих элементов побочных подгрупп.
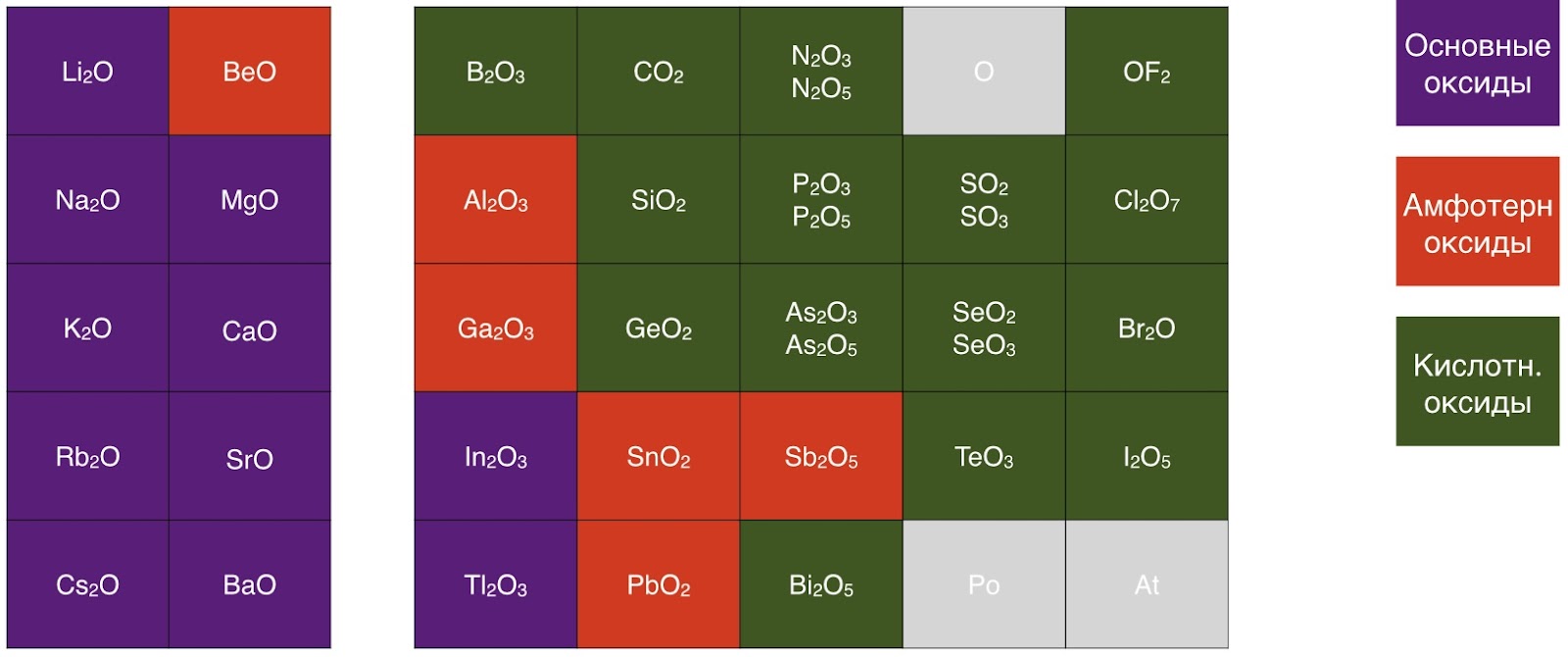
Среди амфотерных оксидов при обычных условиях нет ни газов, ни жидкостей, все они являются твёрдыми веществами. Они нерастворимы или малорастворимы в воде и некоторые обладают характерной окраской (SnO — тёмно-синий, GeO — коричнево-чёрный, PbO — красный, жёлтый или оранжевый).
Большинство оксидов устойчивы к нагреванию, вследствие высокой термической устойчивости, которая обусловлена их строением.Если рассматривать Al2O3, то атомы кислорода образуют кубическую плонтоупакованную структуру. Атомы металла расположены в пустотах структуры. В зависимости от условий получения получают оксиды Al2O3 различного строения. Наиболее устойчивая модификация — α-Al2O3 -корунд. Соединение с такой структурой обладает высокой прочностью и твёрдостью. Если рассмотреть Cr2O3, то он обладает ромбоэдрической структурой типа α-Al2O3 -корунд. Вследствие чего можно сделать вывод, что данное соединение будет термически устойчивым. Обобщёно говоря, термическая устойчивость обусловлена строением амфотерных оксидов.
Амфотерные гидроксиды – твёрдые кристаллические вещества, плохо растворимые в воде. Как правило, они имеют белый цвет, но одно соединение имеет отличную от белой окраску (Cr(OH)3 – серо-зелёный).
Оксиды:
Гидроксиды:
1. Амфотерный оксид + H2O ≠
2. Амфотерные оксиды (гидроксиды) проявляют свойства основных оксидов (оснований) в реакции с кислотами.
Примеры:
ZnO + 2HCl=ZnCl2 + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Al2O3 + 3H2SO4= Al2(SO4)3 + 3H2O
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Как правило, амфотерные оксиды взаимодействуют с сильными и средними по силе кислотами
Степень диссоциации кислоты определяет её силу, про диссоциацию можно почитать здесь.
Амфотерные гидроксиды металлов в степени окисления +3, не реагируют с такими кислотами как, H2S, H2SO3,H2CO3
Из-за того, что соли, которые образовывались бы в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты.
3.Амфотерные оксиды (гидроксиды) проявляют основность при реакции с кислотными оксидами.
Реакция идёт при нагревании, не идёт такая реакция с SO2 и CO2.Реакция идёт с участием высших оксидов, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5)
Примеры:
ZnO + SO3 = ZnSO4
(Zn(OH)2+SO3 = ZnSO4 + H2O)
BeO + N2O5 = Be(NO3)2
(Be(OH)2 + N2O5 = Be(NO3)2 + H2O)
CO2 реагирует с нерастворимыми амфотерными гидроксидами (в степени окисления +2), а также с Cu(OH)2 в виде суспензий в воде с образованием основных солей.
2Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O).
4. Амфотерные оксиды (гидроксиды) проявляют (кислотные) свойства кислотных оксидов в реакциях с основными оксидами (только щелочными и щелочноземельными)
Реакция осуществима как в растворах, так и при сплавлении.
| а) В растворах | б) При сплавлении |
| Основные оксиды в воде сразу переходят в щёлочи и амфотерные оксиды (гидроксиды) реагируют с ними. | — |
| Раствор → комплексная соль | Расплав →t,°C средняя соль (+H2O) |
| Cr2O3 + 3BaO +6H2O = Ba3[Cr(OH)6]2 3BaO + 2Cr(OH)3 + 3H2O = Ba3[Cr(OH)6]2 | Fe2O3 + Cs2O = 2CsFeO2 BaO + 2Cr(OH)3 = Ba(CrO2)2 + 3H2O |
Амфотерные гидроксиды при сплавлении реагируют только с оксидами щелочных и щелочноземельных металлов
5. Амфотерные оксиды (гидроксиды) проявляют (кислотные) свойства кислотных оксидов при взаимодействии с щелочами.
Реакция осуществима как в растворах, так и при сплавлении.
| а) В растворах | б) При сплавлении |
| Раствор → комплексная соль | Расплав →t,°C средняя соль+ H2O |
| ZnO + Ca(OH)2 + H2O = Ca[Zn(OH)4] Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Be(OH)2 + Ba(OH)2 = Ba[Be(OH)4] Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] | PbO + 2LiOH = Li2PbO2 + H2O ZnO + 2NaOH = Na2ZnO2 + H2O Zn(OH)2 + 2LiOH = Li2ZnO2 |
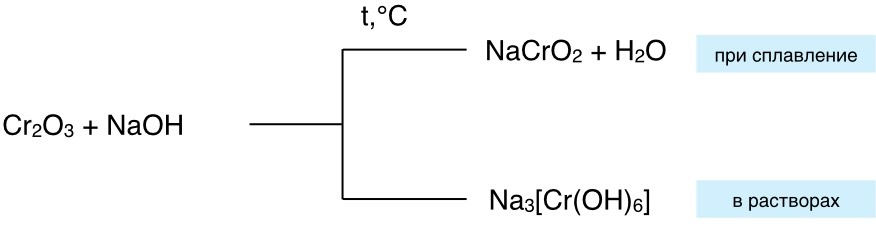
Лишь 2 амфотерных гидроксида Fe(OH)3 и Cr(OH)3 растворяются только в концентрированных растворах щелочей.
Общая схема:
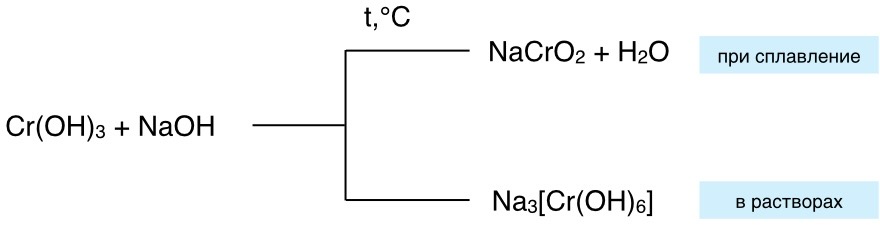
6. Амфотерные оксиды способны при сплавлении с некоторыми солями вытеснять летучие оксиды.
Пример:
BaCO3 + Al2O3 = CO2 + Ba(AlO2)2
Амфотерные гидроксиды взаимодействуют с солями, образованными щелочным металлом и анионом, с которым «амфотерный металл» не может образовать существующую или устойчивую соль, происходит гидролиз этой соли и появление щелочной реакции раствора
Примеры:
Al(OH)3 + Na2S + H2O = Na[Al(OH)4] + NaHS
Cr(OH)3 + Na2SO3 + H2O = Na[Cr(OH)4] + NaHSO3
7. Амфотерные гидроксиды разлагаются при нагревании.
Примеры:
2Fe(OH)3 = Fe2O3 + 3H2O
1.Термическое разложение амфотерных гидроксидов:
Zn(OH)2 → ZnO + H2O
2.Прямое взаимодействие металла с кислородом:
2Be + O2 = 2BeO
Таким способом не получают оксид железа II, т.к при окислении железа образуется Fe3O4
3. Термическое разложение нитратов:
4Cr(NO3)2 = 2Cr2O3 + 8NO2 ↑ + O2 ↑
4.Окисление оксидов с более низкой степенью окисления:
CrO + O2 = Cr2O3
Прибегают к различным способам получения, т.к растворением соответствующего оксида в воде амфотерный гидроксид получить нельзя, из-за маленькой растворимости оксидов.
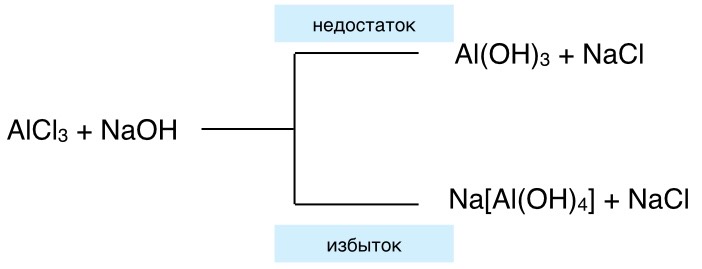
1. Действием раствором щёлочи на растворимую соль, содержащую амфотерный металл:
AlCl3 + 3NaOH = Al(OH)3 ↓ + 3NaCl
В этих реакциях не используются концентрированные растворы щёлочи и большие избытки этих растворов, т.к образуются комплексные соединения
2.Действием аммиака на раствор соли, содержащей амфотерный металл:
ZnBr2 + 2NH3 + 2H2O = Zn(OH)2↓ + 2NH4Br
3.Действием на раствор соли, содержащей амфотерный металл, растворов солей с таким анионом, который не будет образовывать существующих солей с амфотерным металлом (или соли гидролизуются):
AlCl3 + Na2SiO3 + H2O = Al(OH)3 + NaCl + H2SiO3 ↓
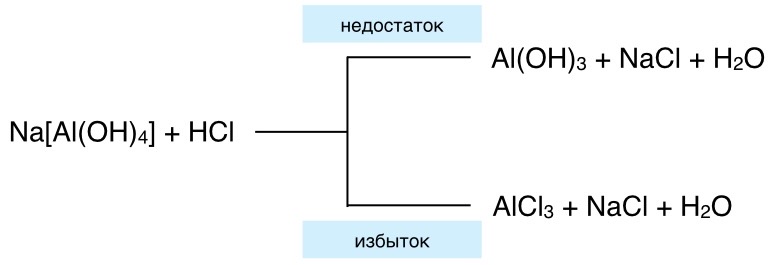
4.Действием разбавленных кислот на гидроксокомплексы:
K3[Fe(OH)6] + 3HBr = 3KBr + 3H2O + Fe(OH)3↓
При добавлении избытка происходит образование двух солей.
5.Действием газа ( CO2, Cl2, HCl) на гидроксоалюминаты, гидроксоферриты и гидроксохромиты, гидроксобериллаты, цинкаты:
2Na3[Cr(OH)6] + 3CO2 = 3Na2CO3 + 2Cr(OH)3↓ + 3H2O
2Na[Al(OH)4] +Cl2 = NaClO + 2Al(OH)3↓+ NaCl + H2O
Памятку по химическим свойствам оксидов и гидроксидов можно скачать по ссылке.
Чтобы закрепить теоретический материал по данной теме, можно пройти тест:
Загрузка…Свинец и олово — типичные представители p-металлов (т.е. металлов, имеющих p-электроны на внешнем энергетическом уровне). В таблице Менделеева олово и свинец находятся в IV-А группе и в 5, 6 периодах соответственно.
Свинец чаще всего встречается в природе в виде двух соединений: свинцового блеска PbS и свинцового сурика Pb3O4. Олово встречается в виде такого минерала, как оловянный колчедан Cu2FeSnS4.
С увеличением порядкового номера металлические и основные свойства усиливаются. В группе IV-A углерод и кремний являются неметаллами, а свинец и олово — металлами. Однако несмотря на это, эти металлы способны также проявлять и неметаллические свойства, что указывает на амфотерность их соединений.
Олово и свинец на внешнем энергетическом уровне имеют ns2np2 электроны. Следовательно, эти металлы имеют степень окисления +4 в качестве высшей. У олова устойчивая степень окисления — +2, +4, у свинца — +2.
В степени окисления +2 олово проявляет восстановительные свойства, типичными восстановителями являются такие соли олова, как SnCl2, Sn(NO3)2.
В степени окисления +4 свинец проявляет очень сильные окислительные свойства, типичными окислителями являются такие соединения свинца, как PbO2, Pb3O4,
Олово и свинец являются металлами, следовательно, обладают металлической решеткой. У олова встречается аллотропная модификация, зависящая от температуры: серое олово и белое. Белое олово (металлический вид) переходит в серое (порошкообразное) при температуре ниже 13.2oС.
Олово и свинец находятся в ряду напряжений до водорода, следовательно, могут взаимодействовать с водой.
!Pb взаимодействует с водой только в присутствии кислорода:
2Pb + H2O + O2 → 2Pb(OH)2
Олово не взаимодействует с водой в обычных условиях, но реагирует с водяным паром при нагревании, образуя высший оксид:
Sn + 2H2O → SnO2 + 2H2
Взаимодействие и с кислотами, и с щелочами обуславливается неметаллическими свойствами металлов.
Реагируют с расплавами щелочей при нагревании с образованием станнатов и плюмбатов:
Sn + 2NaOH(распл) → Na2SnO2 + H2
Pb + 2NaOH(распл) → Na2PbO2 + H2
В растворе щелочей образуются комплексные соединения:
Sn + 2NaOH + 2H2O → Na2[Sn(OH)4] + H2
тетрагидроксостаннат(II) натрия
Pb + NaOH + 2H2O → Na[Pb(OH)3] + H2
тригидроксоплюмбат(II) натрия
Pb + 2NaOH + 2H2O → Na2[Pb(OH)6] + H2
гексагидроксоплюмбат(IV) натрия
Реагируют с кислотами-неокислителями с образованием солей:
Sn + 2HCl(разб) → SnCl2 + H2
Sn + 4HCl(конц) → H2[SnCl4] + H2
Pb + H2SO4(разб), HCl(разб) → пассивация
Pb + 4HCl(конц) → H2[PbCl4] + H2
Олово: При нагревании на воздухе окисляется до оксида олова(IV):
Sn + O2 → SnO2
Свинец: При нагревании на воздухе окисляется до оксида свинца(II):
2Pb + O2 → 2PbO
Олово: При нагревании реагирует с серой, образуя сульфид олова(II):
Sn + S → SnS
Свинец: При нагревании реагирует с серой, образуя сульфид свинца(II):
Pb + S → PbS
!PbS2 не существует из-за сильных окислительных свойств Pb4+ и сильных восстановительных свойств S2-: Pb4+ + S2- → PbS + S
Олово: Реагирует с галогенами, образуя галогениды олова(IV):
Sn + 2Hal2 → SnHal4
Свинец: Реагирует с галогенами, образуя галогениды свинца(II):
Pb + Hal2 → PbHal2
!PbI4 не существует из-за сильных окислительных свойств Pb4+ и сильных восстановительных свойств I—: Pb(NO3)4 + 4KI → PbI2 + I2 + 4KNO3
С раствором хлорида ртути(II) образуется белый осадок хлорида олова(IV), который затем чернеет от металлической ртути:
SnCl2 + 2HgCl2 → SnCl4 + Hg2Cl2↓
Hg2Cl2 + SnCl2 → SnCl4 + 2Hg↓
С раствором иодида калия образуется ярко-желтый осадок иодида свинца(II):
Pb(NO3)2 + 2KI → PbI2↓ + 2KNO3
С раствором хромата калия образуется желтый осадок хромата свинца(II):
Pb(NO3)2 + K2CrO4 → PbCrO4↓ + 2KNO3
Взаимодействует с соляной кислотой, окисляя ее до хлора:
PbO2 + 4HCl → PbCl2 + Cl2 + 2H2O
Взаимодействует с солями меди(II), восстанавливая их до меди(I) или меди(0):
SnCl2 + 2CuCl2 → SnCl4 + 2CuCl↓
SnCl2 + CuCl2 → SnCl4 + Cu↓
Реакции с азотной кислотой:
Sn + 4HNO3(конц) H2SnO3 + 4NO2 + 2H2O
3Sn + 8HNO3(разб) → 3Sn(NO3)2 + 2NO + 4H2O
Реакция с концентрированной серной кислотой:
Sn + 2H2SO4 → SnSO4 + SO2 + 2H2O
Реакции с азотной кислотой:
3Pb + 8HNO3(разб) 3Pb(NO3)2 + 2NO + 4H2O
3Pb + 4HNO3(конц) → Pb(NO3)2 + 2NO2 + 2H2O
Реакция с концентрированной (60%) серной кислотой:
Pb + 3H2SO4 Pb(HSO4)2 + SO2 + 2H2O
SnCl2 — качественный реактив на соединения Bi3+:
SnCl2 + 2BiCl3 + 18NaOH → 3Na2[Sn(OH)6] + 2Bi + 12NaCl — образование черного осадка Bi.
SnO2 — используется как эмаль для покрытия металлов.
Многие соединения свинца используются в качестве пигментов для изготовления красок:
PbCrO4 — хромовая желтая, (PbOH)2CO3 — свинцовые белила, Pb3O4 — сурик (красного цвета.
PbO2 используется в качестве окислителя в свинцовых аккумуляторах.
Соли — это сложные вещества, состоящие из катионов и анионов. В качестве катионов могут выступать ионы металлов или ион аммония NH4+ . Анионами же могут быть кислотные остатки, комплексные частицы или комбинация кислотных остатков и гидроксо-групп.

В зависимости от состава соли можно разделить на несколько групп.

Если рассматривать соли в качестве продуктов замещения, то их можно разделить на 3 группы: средние, кислые и основные.
Средние соли образуются при полном замещении ионов водорода в кислоте катионами металла. Такие соли содержат только катионы металла и кислотный остаток.
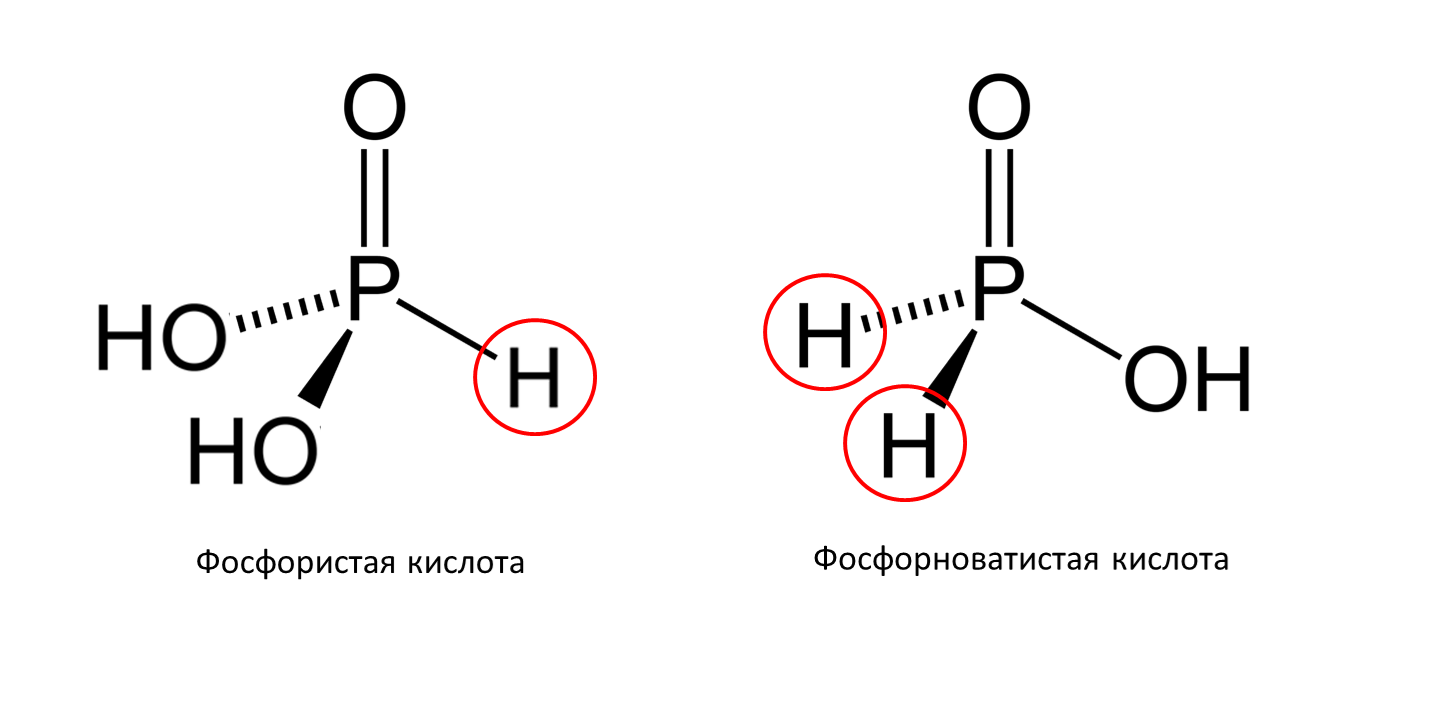
Кислые соли получаются при неполном замещении H+. В их составе присутствуют как ионы водорода, так и катионы металлов. В названии таких солей присутствует приставка «гидро -» . Например, гидрокарбонат натрия (NaHCO3 ).Важно помнить, что фосфиты (K2HPO3) и гипофосфиты (KH2PO2) являются средними солями, несмотря на то, что в их составе содержатся атомы водорода. У данных кислот в составе есть атомы водорода, которые связаны напрямую с атомом фосфора прочный связью, и не могут быть ионизированы. Поэтому фосфористая кислота двухосновная, а фосфорноватистая — одноосновная!
Основные соли являются результатом неполного замещения гидроксид ионов на кислотные остатки, поэтому в их составе находятся OH— группы. Основной солью является, например, гидроксокарбонат меди (II) ((CuOH)2CO3)
По наличию разных типов ионов соли делят на двойные и смешанные. Двойные соли образованы двумя металлами и одной кислотой (KNaCO3 ), а смешанные — одним металлом и двумя кислотами (СuBrCl). Двойные и смешанные соли получаются при совместной кристаллизации нескольких солей, поэтому данный термин применим только к солям в чистом виде. В растворе мы считаем, что находится смесь двух разных солей.
В отдельную группу выделяют комплексные соли — соли, содержащие комплексные ионы.
Примеры комплексных солей:
K3[Fe(CN)6] — гексацианоферрат калия (III) или красная кровяная соль
Na[Al(OH)4] — тетрагидроксоалюминат натрия
Na[Zn(OH)4] — тетрагидроксоцинкат натрия
[Cu(NH3)4]SO4 — сульфат тетраамминмеди (II)
Чтобы правильно составить формулу соли, необходимо помнить, что сумма зарядов катионов должна быть равна сумме зарядов анионов.
Название соли составляют по следующей схеме:
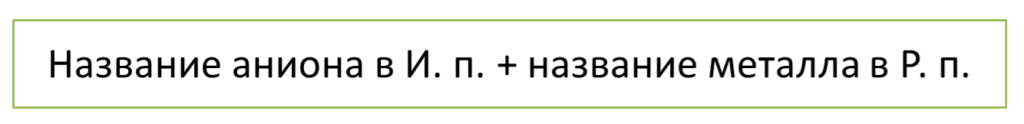
Если металл катиона имеет переменную валентность, то её указывают в скобках римскими цифрами.
В названия кислых и основных солей добавляют приставки “гидро-” и “гидроксо-” соответственно. Если кислота может образовывать несколько кислых солей, то в названии соли необходимо указать количество атомов водорода. Так, для фосфорной кислоты существует гидрофосфат (HPO42-) и дигидрофосфат ((H2PO4—).
Примеры:
MgSO4 — сульфат магния
CuCl2 — xлорид меди (II)
(CuOH)2CO3 — карбонат гидроксомеди (II)
NH4H2PO4 — дигидрофосфат аммония
Соли могут быть получены во многих химических процессах, рассмотрим основные их них.
2Fe + 3Cl2 = 2FeCl3
Металл способен вытеснять водород из кислоты, если он стоит левее водорода в ряду напряжения металлов.
Zn + 2HCl = ZnCl2 + H2↑
С щелочами могут взаимодействовать металлы, способные проявлять кислотные свойства (Al, Zn, Fe и др.)
2Al + 6NaOH(тв.) = 2NaAlO2 + 2Na2O + 3H2↑
2Al + 2NaOH(раств.) + 6H2O = 2Na[Al(OH)4] + 3H2↑
a) Основный оксид + кислотный оксид
CaO + SO2 = CaSO3
b) Основный оксид + амфотерный оксид
Fe2O3 + 6HNO3(разб.) = 2Fe(NO3)3 + 3H2O
Fe2O3 + 6HNO3(разб.) = 2Fe(NO3)3 + 3H2O
a) Сильное основание + любой кислотный оксид
2NaOH + CO2 = Na2CO3
NaOH + CO2(изб.) = NaHCO3
b) Нерастворимое основание +кислотный оксид сильной кислоты
Cu(OH)2 + SO3 = CuSO4 + H2O
Cu(OH)2 + CO2 ≠
Реакцией нейтрализации называют взаимодействие между кислотой и основанием, в результате которого образуется соль и вода.
KOH + CH3COOH = CH3COOK+H2O
Новая соль образуется если выполняются условия проведения реакции ионного обмена (см. “Основные химические реакции с участием солей п.2”)
AgNO3 + KI = AgI↓ + KNO3
Реакция такого типа протекает если замещающий металл находится левее в ряду активности металлов, чем металл, входящий в состав исходной соли.
Zn + CuSO4 = ZnSO4 + Cu
Hg+Na2SO4⇏реакция не идёт

Реакция ионного обмена протекает если в ходе реакции образуется осадок, выделяется газ или образуется малодиссоциирующий электролит (например вода).
NaOH + NH4Cl = NaCl + NH3 ↑+ H2O
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Zn(CH3COO)2+2HBr = ZnBr2 + 2CH3COOH
Более подробно о реакциях ионного обмена можно узнать тут.
Некоторые соли могут быть участниками окислительно — восстановительных процессов. К типичным окислителям можно отнести перманганаты (KMnO4), дихроматы (K2Cr2O7), перхлораты (NH4ClO4) и др. Восстановительными свойствами обладают такие соли, как сульфиды (ZnS), галогениды (KI, NaBr), соли двухвалентного железа (FeSO4), трехвалентного хрома (Cr(NO3)3) и др. Некоторые соли могут проявлять окислительно-восстановительную двойственность, например сульфиты (Na2SO3).
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
6NaI + K2Cr2O7 + 7H2SO4 → 3Na2SO4 + 3I2 + Cr2(SO4)3 + K2SO4 + 7H2O
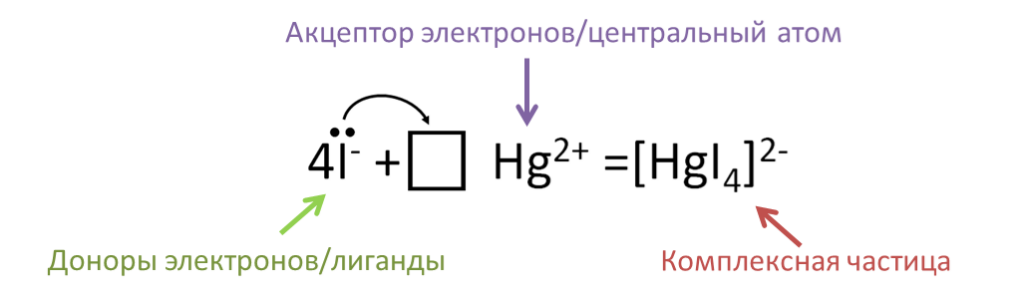
Некоторые соли способны участвовать в образовании комплексов. Комплексная частица образуется за счет образования ковалентной связи между центральным атомом и лигандами по донорно-акцепторному механизму. Центральный атом предоставляет свободные атомные орбитали, а лиганды — электронные пары.
Cu(NO3)2 + 4NH3 = [Cu(NH3)4](NO3)2
2NaF + SiF4 = Na2[SiF6]
2KI + HgI2 = K2[HgI4]
В последней реакции атом ртути является центральным атомом, у него есть свободные атомные орбитали, и он может быть акцептором электронов. Атомы йода являются донорами электронов и выступают в роли лигандов . Данные атомы образуют комплексную частицу путем образования ковалентных связей. Ионы калия в свою очередь являются внешнесферными и связаны с комплексной частицей ионной связью.
Кислые соли взаимодействуют с щелочами с образованием средних солей
NaHSO4 + NaOH = Na2SO4 + H2O
KHCO3 + KOH → K2CO3 + H2O
2NaHCO3 + Ca(OH)2 = Na2CO3 + CaCO3 ↓+ 2H2O
В данной реакции гидрокарбонат ионы в присутствии щелочи образуют карбонат ионы, которые взаимодействуют с катионами натрия и кальция одновременно. Кислые соли реагируют с любыми щелочами, в том числе теми, которые образованы другим металлом.
Аналогично, основные соли взаимодействуют с сильными кислотами с образованием средних солей.
Zn(OH)Cl + HCl = ZnCl2 + H2O
Основные соли также могут взаимодействовать с сильными кислотами с другим кислотным остатком, в результате образуются средние соли.
Mg(OH)2CO3 + 2HNO3 = Mg(NO3)2 + CO2 ↑+ H2O
2Cu(OH)Cl+2HBr = CuCl2 + CuBr2 + 2H2O
(см. тему “Разложение солей”)
(см. тему “Гидролиз солей в водном растворе”)
Для лучшего запоминания основных химических свойств солей мы подготовили удобную памятку, которую можно найти перейдя по ссылке:
Чтобы лучше усвоить данный материал предлагаем вам пройти проверочный тест:
Кислоты – сложные вещества, состоящие из катионов H+ и аниона кислотного остатка (NO3— , SO42-, Cl— и другие)
1. По содержанию кислорода:
а) кислородосодержащие (H2SO4, HNO3, HNO2 и тд);
б) бескислородные (HCl, HBr, HCN и тд).
2. По основности:
а) одноосновные (HNO3, HI, HF и тд) ИСКЛЮЧЕНИЕ H3PO2;
б) двухосновные (H2SiO3, H2SO4, H2S и тд) ИСКЛЮЧЕНИЕ H3PO3;
в) трехосновные (H3PO4).
Подробнее про исключения можно прочитать в этом конспекте
3. По силе кислот:
а) сильные:
1) бескислородные: HCl, HBr, HI;
2) кислородосодержащие: HXЭОy где y-x ≥ 2.
Например: H2Cr2O7
6-2=4 ≥ 2, значит кислота сильная
Мы считаем только концевые атомы кислорода, в данной кислоте 1 атом кислорода является мостиковым, его мы не учитываем при подсчете
б) слабые:
1) бескислородные: HCN, HF, H2S;
2) кислородосодержащие: HXЭОy где y-x < 2 ИСКЛЮЧЕНИЕ H3PO3.
Например: HClO2
2-1=-1 < 2, значит кислота слабая
Также как и основания, сильные кислоты в растворе диссоциируют полностью и их диссоциацию можно написать в одну стадию:
H2SO4 = 2H+ + SO42-
А слабые кислоты почти не диссоциируют, их диссоциацию мы расписываем по ступеням:
H3PO4 = H+ + H2PO4—
H2PO4— = H+ + HPO42-
HPO42- = H+ + PO43-
(в РИО не расписываем слабую кислоту на ионы, даже кислотный остаток кислых солей)
1. Кислотный оксид + вода (кислота должна быть растворимой)
SO3 + H2O = H2SO4
2NO2 + H2O = HNO3 + HNO2 !
2. Соль 1 + кислота 1 = соль 2 + кислота 2, сильная кислота должна вытеснять слабую или должен выпадать осадок/выделяться газ
CaCO3 + HCl = CaCl2 + CO2↑ + H2O
2NaNO2 + H2SO4 = Na2SO4 + 2HNO2
3. Из простых веществ (кислоты из двух элементов)
H2 + Cl2 = 2HCl
H2 + S = H2S
4. В ОВР
P + 5HNO3 = H3PO4 + 5NO2↑ + H2O
4NO2 + 2H2O + O2 = 4HNO3
1. Взаимодействие с основными оксидами:
2HCl + CaO = CaCl2 + H2O
2. Взаимодействие с основаниями:
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O
3. Взаимодействие сильной кислоты с амфотерными оксидами:
ZnO + H2SO4 = ZnSO4+ H2O
4. Взаимодействие сильной кислоты с амфотерными гидроксидами:
2Al(OH)3 + 6HCl = AlCl3 + 3H2O
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты
5. Взаимодействие с металлами стоящих в ряду активности до H2
Fe + 2HCl = FeCl2 +H2↑
6. Разложение
а) самопроизвольноe:
H2CO3 = СO2↑ + H2O
H2SO3 = SO2↑ + H2O
Такие кислоты являются нестабильными веществами и существуют лишь в малых концентрациях в растворе. В растворе они находятся в равновесии со своими оксидами – углекислым газом и сернистым газом соответственно, причем равновесие сильно смещено вправо
б) при нагревании:
H2SiO3 = SiO2↓ + H2O
2HI = H2↑ + Cl2↑
2HIO3 = I2O5↓ + H2O
4HNO3 = O2↑ + 2H2O + 4NO2↑
8HClO3 = 4HClO4 + 3O2↑ + 2Cl2↑ + 2H2O.
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными. Для того, чтобы правильно составлять реакции ионного обмена (полные ионные уравнения и сокращенные), необходимо разобраться в том, что такое электролиты.
Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов).
Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Электролиты делят на сильные и слабые. К сильным электролитам относят вещества, которые хорошо диссоциируют, а к слабым – которые диссоциируют плохо. Вещества, которые не диссоциируют, называются неэлектролитами.
| Электролиты | Неэлектролиты | |
| Слабые электролиты | Сильные электролиты | |
| Слабые кислоты | Сильные кислоты | Оксиды, не взаимодействующие с водой |
| Нерастворимые основания и гидроксид аммония | Щелочи | Простые вещества |
| Растворимые и нерастворимые соли | Большинство органических соединений | |
Абсолютно нерастворимых веществ не бывает, небольшая часть молекул растворяется и диссоциирует, поэтому нерастворимые соли являются электролитами.
Поскольку сильные электролиты диссоциируют хорошо, то в растворе они находятся почти полностью в виде ионов, поэтому в ионном уравнении мы должны расписать их в виде ионов. Рассмотрим, какие это вещества:
Все растворимые соли:
Расписываем их на катионы металла и анионы кислотного остатка (или комплексные ионы)
NaCl = Na+ + Cl—
K2SO4 = 2K+ + SO42-
K2HPO4 = 2K+ + HPO42- — если соль кислая, то ее кислотный остаток мы НЕ расписываем на ионы, а пишем так как есть (исключение HSO4— = H+ + SO42- — этот ион на ЕГЭ можно расписывать, а можно не расписывать).
K[Al(OH)4] = K+ + [Al(OH)4]— — комплексные ионы мы также не расписываем
Сильные кислоты:
Кислоты расписываем на катионы водорода и кислотные остатки
HCl = H+ + Cl—
H2SO4 = 2H+ + SO42-
Сильные основания:
Основания расписываем на катионы металла и гидроксид-анионы
KOH = K+ + OH—
Ca(OH)2 = Ca2+ + 2OH—
Слабые электролиты плохо диссоциируют и поэтому находятся в растворе преимущественно в молекулярной форме (не в виде ионов). Из этого можно сделать вывод, что расписывать такие вещества на ионы НЕЛЬЗЯ. Также нельзя расписывать на ионы нерастворимые соли, хотя они и являются сильными электролитами, но они просто почти не растворяются, а поэтому и на ионы распасться не могут (но та малая часть, которая растворилась, будет находится в растворе в виде ионов).
Кого мы не расписываем на ионы:
1. Слабые кислоты: HF, H2SiO3, H3PO4
2. Слабые основания: Fe(OH)2, Cu(OH)2
3. Амфотерные гидроксиды: Al(OH)3, Zn(OH)2
4. Газы: СO2, SO2, NH3
5. Анионы кислых солей: HCO3—, HS—, HPO42-
6. Анионы комплексных солей: [Al(OH)4]—, [Zn(OH)4]2-
7. Осадки солей: BaSO4, AgCl
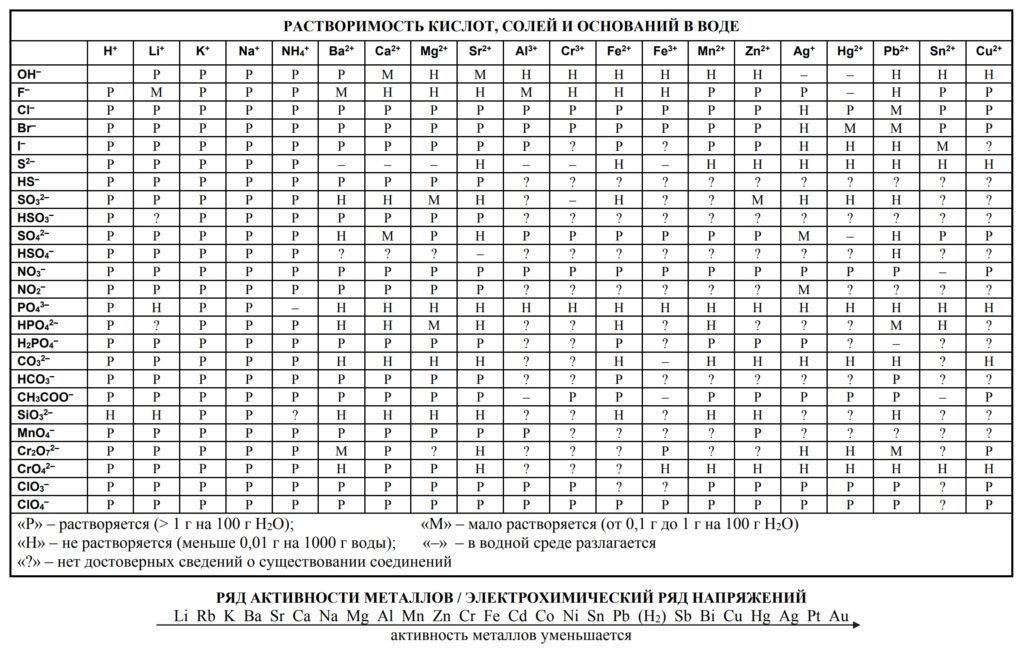
Нерастворимые и малорастворимые соединения обозначают буквами Н и М, если соль малорастворима, в продуктах её мы НЕ расписываем на ионы , однако гидроксиды являются сильными основаниями, их мы расписываем. В случае если малорастворимое вещество выступает в качестве реагента, мы его также расписываем на ионы.
В зависимости от того, кто вступает в реакцию ионного обмена, могут быть различные условия протекания реакции. Рассмотрим их:
1) кислота + основание = соль + вода
условие: сильное основание или растворимая нелетучая кислота
Кислоты, которые нам не подходят: H2CO3, H2SO3, H2SiO3
KOH + HNO3 = KNO3 + H2O
Cu(OH)2 + H2SO4 = CuSO4 + H2O
2) кислота + соль = другая кислота + другая соль
условие: образуется соль, нерастворимая в кислотах, или сильная кислота вытесняет более слабую из соли Соли не растворимые в кислотах:
а) нерастворимые соли с кислотным остатком SO42-(BaSO4, SrSO4, PbSO4)
б) нерастворимые соли с кислотным остатком S2-(CuS, Ag2S, Pb2S)
в) нерастворимые соль с кисл.остатком Cl—, Br—, I—(AgCl, AgBr, AgI)
Осадок соли: AgNO3 + HCl = AgCl↓ + HNO3
Осадок кислоты: Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
Выделение газа: Na2S + H2SO4 = Na2SO4 + H2S↑
3) соль + соль = другая соль + другая соль
условие: реагенты растворимы, в результате образуется осадок
CuSO4 + Na2S = CuS↓ + Na2SO4
AgNO3 + NaCl = AgCl↓ + NaNO3
4) соль + основание = другая соль + другое основание
условие: выделяется осадок, газ или слабый электролит
Выделение газа: NH4Cl + KOH = NH3↑ + H2O + KCl
Осадок соли: Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
Осадок гидроксида: Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3
1. Выбираем вещества в соответствии с условиями задания взаимодействия этих веществ, описанными выше
2. Проверяем степени окисления, в РИО они меняться не должны
3. Составляем ионные уравнения по схеме:
1) в виде ионов записывают сильные кислоты, щелочи и растворимые соли;
2) все остальные вещества оставляют в молекулярном виде, это осадки, газы и слабые электролиты;
3) правильное расставляем заряды ионов исходя из таблицы расвторимости;
4) одинаковые ионы сокращаем и получаем краткое ионное уравнение.
ZnF2 + 2HNO3 = Zn(NO3)2 + 2HF↑
Zn2+ + 2F— + 2H+ + 2NO3— = Zn2+ + 2NO3— + 2HF↑
2F— + 2H+ = 2HF↑ :2 (На экзамене писать не нужно!)
F— + H+ = HF↑
Разложение солей можно разделить на две большие группы:
То, к какой из групп будет относится разложение той или иной соли зависит от ее состава: для протекания ОВР необходимо наличие в соли довольно сильного окислителя:S+6 N+5 N+3 Cl+n и другие галогены в положительной СО, Mn+7, Mn+6, Cr+6, восстановитель же найдется всегда, им может быть (часто и бывает) O-2 или металл, если он в низкой СО и способен окисляться до более устойчивой СО, например Fe+2 в Fe+3 или Mn+2 в Mn+4 (также может быть с оловом: из +2 в +4 и Cr из +2 в +3).
Продуктами «ОВРного» разложения солей часто являются оксиды, содержащие элемент-окислитель в устойчивой СО и кислород.
Продуктами «не ОВРного» разложения являются «составные части» разлагающейся соли, т.е. это могут быть кислотный и основный оксид, из которых образована эта соль или (в случае солей аммония) это аммиак и кислота, с которой он должен был прореагировать, чтобы образовать данную соль.
Разложение карбонатов относится к не ОВРному типу, поскольку СО +4 для углерода устойчива и окислительных свойств он не проявляет, соответственно, карбонаты разлагаются на углекислый газ и оксид соответствующего металла, при этом изменения степеней окисления не происходит. Стоит помнить, что карбонаты щелочных металлов не разлагаются, за исключением карбоната лития.
Li2CO3 → Li2O + CO2
CaCO3 → CaO + CO2
MgCO3 → MgO + CO2
Разложение кислых солей, как мы увидим на следующих примерах, происходит сначала с выделением соответствующей кислоты (которая может разлагаться, если она неустойчива, например, угольная кислота распадется на углекислый газ и воду) и средней соли. Средняя соль при дальнейшем прокаливании может разлагаться (возможен вариант, что дальнейшего разложения не будет, например, если в ходе разложения кислой соли получится карбонат натрия, то он дальше разлагаться не будет, поскольку это карбонат ЩМ, а вот карбонат кальция разлагаться будет – см. п.1.)
Гидрокарбонаты разлагаются на карбонаты, углекислый газ и воду (можно представить что гидрокарбонат это смесь карбоната и угольной кислоты, в первую очередь разлагается угольная кислота)
2NaHCO3 → Na2CO3•H2CO3
H2CO3 → CO2 + H2O
2NaHCO3 → Na2CO3 + CO2 + H2O
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Разложение сульфатов относится к ОВРному типу, поскольку данные соли содержат серу в СО +6, которая выступает в качестве окислителя, восстановителем здесь всегда будет кислород.
Сульфаты ЩЗМ и некоторых других металлов разлагаются до оксида соответствующего металла (с той же СО, что и в сульфате), сернистый газ и кислород.
2MgSO4 → 2MgO + 2SO2 + O2
2CuSO4 → 2CuO + 2SO2 + O2
2BaSO4 → 2BaO + 2SO2 + O2
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2Fe2(SO4)3 → 2Fe2O3 + 6SO2 + 3O2
Исключениями являются сульфаты таких неактивных металлов, как серебро и ртуть, в этом случае образуется сам металл, а не его оксид. Это связано с тем, что ионы малоактивных металлов сами проявляют окислительные свойства – для таких металлов устойчивой СО является 0, в нее они и переходят (в этом легко убедиться, поскольку малоактивные металлы часто встречаются в природе в самородном виде, т.е. не в составе соединений, поэтому они были известны человечеству уже очень давно)
Ag2SO4 → 2Ag + SO2 + O2
2HgSO4 → 2Hg + 2SO2 + O2
Также исключением является сульфат двухвалентного железа, вместо оксида двухвалентного железа выделяется более устойчивый оксид трехвалентного железа:
2Fe2(SO4)3 → 2Fe2O3 + 6SO2 + 3O2.
Сульфиты ЩМ разлагаются до сульфидов и сульфатов, это можно объяснить тем, что сера находится в СО +4, которая является для нее промежуточной, поэтому она может выступать и в качестве окислителя и в качестве восстановителя, что мы и наблюдаем:
4Na2SO3 → Na2S + 3Na2SO4
Гидросульфиты разлагаются аналогично гидрокарбонатам, т.е. сначала выделяется сернистая кислота, которая разлагается на сернистый газ и воду, и средняя соль – сульфит, который в дальнейшем может тоже разлагаться по схеме, приведенной выше.
2KHSO3 → K2SO3•H2SO3
H2SO3 → H2O + SO2
2KHSO3 = K2SO3 + H2O + SO2
Разложение гидросульфатов происходит аналогично
2KHSO4 = K2SO4 +H2O + SO3
Разложение нитратов можно описать схемой:
Нитрат -> нитрит -> оксид -> металл
Сначала происходит разложение нитрата до нитрита, однако при высокой температуре сам нитрит может оказаться неустойчивым (если металл не очень активный), тогда уже нитрит разлагается с образованием оксида, однако и некоторые оксиды (в случае малоактивных металлов) могут разлагаться на металл и кислород. Тогда в зависимости от активности металла получим следующую схему:
| MeNO3 | ||
| левее Mg | Mg-Cu | правее Cu |
| MeNO2 + O2 например: | MeO + NO2 + O2 например: | Me + NO2 + O2например: |
| 2KNO3 → 2KNO2 + O2 | 2Mg(NO3)2 → 2MgO + 4NO2 + O2 | 2AgNO3 → 2Ag + 2NO2 + O2 |
| 2NaNO3 → 2NaNO2 + O2 | 2Mg(NO3)2 → 2MgO + 4NO2 + O2 | |
Исключениями являются нитраты лития, марганца и двухвалентного железа (в случае марганца и железа изменение продуктов реакции по сравнению со стандартной схемой вызвано тем, что металл находится не в самой устойчивой своей степени окисления, в результате чего окисляется, переходят в самую «привычную» СО):
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Mn(NO3)2 → MnO2 + 8NO2
4LiNO3 → 2Li2O + 4NO2 + O2
Разложение солей аммония происходит без изменения степеней окисления, если в соли отсутствует окислитель (S+6 N+5 N+3 Cl+n и другие галогены в положительной СО, Mn+7, Mn+6, Cr+6), например, галогениды аммония разлагаются на аммиак и соответствующий галогеноводород:
NH4Cl → NH3 + HCl
NH4Br → NH3 + HBr
NH4I → NH3 + HI
Гидрофосфаты аммония постепенной отщипляют аммиак:
(NH4)2HPO4 = NH3 + NH4H2PO4
NH4H2PO4 = NH3 + H3PO4
Аналогично разлагается и карбонат аммония:
(NH4)2CO3 = NH3 + NH4HCO3
NH4HCO3 = NH3 + H2O + CO2
Разложение дихромата аммония – знаменитая реакция «вулканчик» протекает согласно уравнению:
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
В этой реакции уже происходит изменение СО, данная реакция является окислительно-восстановительной, поскольку в соли присутствует хром в СО +6, который выступает окислителем, а азот в СО -3 – восстановителем.
Разложение солей аммония и азотсодержащих кислот также является ОВРным, поскольку данные соли содержат N+5 и N+3, которые также выступают окислителями, а также N-3 – восстановитель. В итоге происходит сопропорционирование – ОВР, в ходе которой один и тот же элемент находящийся в различных СО является и окислителем, и восстановителем. Продукты этих реакций легко запомнить так:
«отщепляются две молекулы воды и записываем то, что осталось»
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
Данные реакции также являются окислительно-восстановительными, поскольку каждая из этих солей содержит элемент в высокой СО, который будет выступать окислителем.
Перманганат:
2KMnO4 → K2MnO4 + MnO2 + O2
Перхлорат:
KClO4 → KCl + 2O2
Хлорат (возможно два варианта реакции – с катализатором и без него):
С катализатором:
2KClO3 → 2KCl + 3O2
Без катализатора:
4KClO3 → 3KClO4 + KCl
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.
Примеры оксидов: ZnO Fe2O3 MnO2 CrO3
Похожие вещества, но не оксиды: H2O2 Na2O2 K2O2 BaO2 CaO2 (пероксиды, степень окисления кислорода равна -1), KO2 CsO2 (супероксиды), OF2 – фторид кислорода (степень окисления кислорода равна +2)
Оксиды делять на солеобразующие и несолеобразующие.
Несолеобразующие оксиды – это оксиды, которым не соответствуют гидроксиды, к ним относятся N2O NO CO SiO.
Остальные оксиды – солеобразующие.
Солеобразующие оксиды в свою очередь делятся на основные, амфотерные и кислотные.
Основные оксиды – оксиды МЕТАЛЛОВ в низких степенях окисления (+1 и +2), кроме BeO ZnO PbO SnO (они являются исключениеми относятся к амфотерным). Этим оксидам соответствуют основные гидроксиды (основания).
ПРИМЕРЫ: Na2O FeO CrO CaO Li2O Cu2O CuO
Амфотерные оксиды – оксиды МЕТАЛЛОВ в степенях оксиления +3 и +4, а также оксиды BeO ZnO PbO SnO. Этим оксидам соответствуют амфотерные гидроксиды.
ПРИМЕРЫ: Al2O3 MnO2 PbO2 ZnO Cr2O3 Fe2O3 SnO
Кислотные оксиды – это все оксиды НЕМЕТАЛЛОВ кроме несолеобразующих и оксиды МЕТАЛЛОВ в высоких степенях окисления (+5 +6 +7). Кислотным оксидам соответствуют кислотные гидроксиды (кислоты).
ПРИМЕРЫ: Mn2O7 CrO3 SO3 SO2 SiO2 CO2 P2O5 P2O3 NO2 N2O5
Многие металлы и неметаллы взаимодействуют с кислородом, образуя оксиды.
N2 + O2 → 2NO
S + O2 → SO2
2Ca + O2 → 2CaO
4Al + 3O2 → 2Al2O3
Исключением являются благородные металлы (серебро, золото, платина), инертные газы (гелий, неон, аргон, ксенон и т.д.) и галогены (Cl2 Br2 I2) – они не взаимодействуют с кислородом. Также исключением являются ЩМ кроме лития, они с кислородом взаимодействуют, но образуют не оксиды, а пероксиды (натрий) и супероксиды (калий, рубидий, цезий).
O2 + 4Li → 2Li2O
O2 + 2Na → Na2O2
O2 + K → KO2
Элементы, у которых существует несколько оксидов, могут давать тот или иной оксид в зависимости от условий реакции (температуры, избытка или недостатка кислорода и т.п., при этом, чем более жесткие условия реакции – тем выше будет степень окисления элемента в получаемом оксиде).
Так, железо при сгорании на воздухе образует железную окалину.
2O2 + 3Fe → Fe3O4
Но могут получится и другие оксиды ( например, оксид железа (II) более устойчив при высоких температурах, поэтому реакцию стоит проводить при температуре 1000оС или выше, а затем быстро охлаждать, чтобы не допустить повторного окисления, либо же реакцию можно проводить при недостатке кислорода, а вот оксид железа (III) можно получить с использованием избытка кислорода при температуре около 500 оС)
3O2 + 4Fe → 2Fe2O3
2Fe + O2 → 2FeO
Аналогично с фосфором ( один пример с неметаллом, но подобным образом может себя вести не только фосфор, но и углерод):
4P + 5O2(изб.) → 2P2O5
4P +3O2(нед.) → 2P2O3
Карбиды, гидриды, фосфиды, сульфиды, оксиды (с элементом в не высшей степени окисления) и некоторые другие бинарные соединения (бинарные – состоящие из двух элементов) также могут быть окислены кислородом.
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
Разложение может происходить самопроизвольно:
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → H2O + NH3
2AgOH → H2O + Ag2O
2CuOH → H2O + Cu2O
Или при прокаливании:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → 3H2O + Fe2O3
Также разложение может происходить под действием излучения, например, азотная кислота на свету разлагается с выделением бурого газа:
4HNO₃ = 4NO₂ + 2H₂O + O₂
Разложение солей может быть окислительно-восстановительным:
2MgSO4 → 2MgO + 2SO2 + O2
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
2KMnO4 → K2MnO4 + MnO2 + O2
И не окислительно-восстановительным (подробнее в «Разложении солей»):
CaCO3 → CaO + CO2
MgCO3 → MgO + CO2
Реакция возможно в том случае, если образуется растворимый гидроксид
Na2O + H2O → 2NaOH
SO3 + H2O → H2SO4
CuO + H2O ≠
ZnO + H2O ≠
SiO2 + H2O ≠
1) Для протекания реакции оксиды должны не относится к одному классу.
Т.е. реакция возможна между кислотным и основным, основным и амфотерным, кислотным и амфотерным оксидами и невозможна между основным и основным, кислотным и кислотным, амфотерным и амфотерным.
Li2O + CaO ≠
N2O5 + CO2 ≠
BeO + ZnO ≠
2) В реакцию с амфотерными оксидами, а также CO2 SO2 SiO2 вступают лишь оксиды, которым соответствует сильный электролит (щелочь в случае основных оксидов и сильная кислота в случае кислотных)
K2O + SO2 → K2SO3
Cr2O3 + 3SO3 → Cr2(SO4)3
K2O + ZnO → K2ZnO2
CuO + CO2 ≠
CuO + Al2O3 ≠
CuO + H2SiO3 ≠
СuO + H2SO4 = CuSO4 +H2O
ZnO + Cu(OH)2 ≠
ZnO + 2KOH = K2ZnO2 + H2O — сплавление (особенности амфотерных оксидов подробнее рассмотрены в конце главы)
4) Оксид1 + соль1 = соль2 + оксид2
С солями реагируют только нелетучие кислотные оксиды и амфотерные оксиды, при этом обязательно должно происходить вытеснение более летучего кислотного оксида из состава соли, т.е. в данную реакцию вступают карбонаты, сульфиты (возможна также реакция с фосфатами, но в ЕГЭ она встречается только в составе более сложной реакции получения белого фосфора).
СaCO3 + SiO2 = CaSiO3 +CO2
K2SO3 + CaO ≠
NaCl + Al2O3 ≠
Na2CO3 + ZnO → Na2ZnO2 + CO2
Реакция получения белого фосфора:
Ca3(PO4)2 + 3SiO2 + 5C → 2P + 3 CaSiO3 + 5CO
5) Восстановление оксидов
Оксиды металлов, стоящий в ряду активности правее алюминия, можно восстановить до металлов различными восстановителями, например: H2, CO, C, Al(Mg)
FeO + C → Fe + CO
Fe2O3 +3CO → 2Fe +3CO2
CuO + CO → Cu + CO2
Cu + H2 → Cu + H2O
CuO + Mg → Cu +MgO
При этом оксиды металлов, стоящих левее алюминия в ряду активности, также взаимодействуют с углеродом с образованием карбидов:
CaO +3C → CaC2 + CO
Оксиды металлов, стоящих правее водорода в ряду активности, можно восстановить аммиаком:
3CuO +2NH3 → 3Cu + 3H2O + N2
Некоторые оксиды неметаллов также можно восстановить (в данном случае правильнее говорить о том, что оксиды неметаллов проявляют свойства окислителей). Например, оксиды азота:
N2O + H2 → N2 + H2O
N2O + Mg → N2 + MgO
N2O + 2Cu → N2 + Cu2O
3N2O + 2NH3 → 4N2 + 3H2O
2NO + 2H2 → N2 + 2H2O
2NO2 + 2C → N2 + 2CO2
6) Окисление оксидов
Окислить можно оксиды, в состав которых входит элемент в промежуточной степени окисления
2NO + O2 → 2NO2
2SO2 + O2 → 2SO3
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
4FeO + O2 → 2Fe2O3
Cr2O3 + O3 + 4KOH → 2K2CrO4 +2H2O
7) Свойства амфотерных оксидов
Амфотерные оксиды могут проявлять как слабые основные так и слабые кислотные свойства, поэтому они могут реагировать как с кислотными оксидами/гидроксидами, так и с основными.
В реакцию с амфотерными оксидами вступают лишь сильные электролиты (в случае с гидроксидами и кислотами) или оксиды, которым соответствуют сильные электролиты.
Al2O3 + Na2O → 2NaAlO2
Al2O3 + 3SO3 → Al2(SO4)3
Al2O3 + SO2 ≠
Al2O3 + H2SiO3 ≠
С основными гидроксидами (щелочами в данном случае, поскольку слабые основания в эти реакции не вступают) реакция может протекать в расплаве, при этом образуется средняя соль (ее также можно рассмотривать как двойной оксид, это удобно для определения продуктов реакций с такими солями):
Al2O3 + NaOH → 2NaAlO2 + H2O
ZnO + 2KOH = K2ZnO2 + H2O
Или в растворе, при этом образуются комплексные соли:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Комплексные соли удобно рассматривать как гидроксид щелочного металла и амфотерный гидроксид, например, разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Удобство заключается в легкости определения и запоминания продуктов:
Na[Al(OH)4] + HCl(нед.) = NaCl + Al(OH)3 + H2O
Na[Al(OH)4] ≡ NaOH + Al(OH)3
В первую очередь прореагирует более активный гидроксид – NaOH
Тогда пишем продукты реакции NaOH + HCl = NaCl + H2O и дописываем непрореагировавший гидроксид Al(OH)3. Подобным образом можно рассуждать и в случае реакции с кислотными оксидами и с солями (AlCl3 NH4Cl)
3Na[Al(OH)4] + AlCl3 = 4Al(OH)3 + 3NaCl
Na[Al(OH)4] ≡ NaOH + Al(OH)3
C хлоридом алюминия будет реагировать только NaOH, запишем реакцию
3NaOH + AlCl3 = Al(OH)3 + 3NaCl
И вновь мы просто записываем продукты этой реакции и дописываем непрореагировавший гидроксид алюминия (здесь он уже есть в продуктах, поэтому повторно его писать не надо, его кол-во учтется в коэффициентах).
Несмотря на то, что подобный прием кажется неправильным с точки зрения химии, в нем есть определенный смысл:
Комплексный ион — слабый электролит, а значит он способен диссоциировать, обратимо (равновесие сильно сдвинуто в сторону комплекса), но все же:
[Al(OH)4]— = OH— + Al(OH)3 (причем диссоциация будет проходить преимущественно по первой ступени, т.к. обычно сила электролита с каждой последующей ступенью диссоциации уменьшается)
Мы видим, что продуктами диссоциации комплекса является гидроксид-ион (его то мы и записали в виде щелочи) и гидроксид алюминия. Можно предположить, что реакция идет именно с продуктами диссоциации комплекса, а не с самим комплексным ионом. Тогда в ходе реакции концентрация продуктов падает, что приводит к смещению равновесия в правую сторону (к разрушению комплекса).
Поскольку в продуктах диссоциации присутствует гидроксид-ион, определяющий щелочную среду раствора данного комплекса, то логично предположить, что с подобными комплексами будут реагировать вещества, способные создать кислую среду в растворе (будет происходить взаимодействие H+ c OH— с образованием Н2О). К подобным веществам можно отнести:
Кислоты: HCl = H+ + Cl—
Кислотные оксиды: SO2 + H2O = H2SO3 = H+ + HSO3—
Соли, образованные сильной кислотой и слабым основанием, поскольку они подвергаются гидролизу по катиону и также имеют кислую среду
AlCl3 + H2O = Al(OH)Cl2 + HCl (процесс обратимый, среда будет слабокислой)
Валентность азота равна 3,(это связано с тем, что в атомах элементов второго периода может быть не более 3 неспаренных электронов, т.к на втором электронном уровне есть одна s-орбиталь и три p-орбитали.) а степень окисления +5. Двойная связь равномерно распределена между кислородами. Подробнее про валентность можно прочитать тут.
Бесцветная жидкость с едким запахом, “дымит” на воздухе. Считается концентрированной при 40% и больше. Имеет схожие особенности с другими кислотами, но имеет отличительные качества за счет сильной окислительной способности.
Азотная кислота обладает ядовитыми свойствами, она разрушает белок кожи и оставляет желтые пятна в результате попадания кислоты на кожу (смотри пункт 7.)
Разложение азотной кислоты:
Частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 + O2 + 2H2O .
на свету желтеет за счет выделения бурого газа- оксида азота(IV), так в процессе разложения кислоты образуется кислород и вода.
В лаборатории азотную кислоту получают следующими способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата лития при легком нагревании, в продуктах у нас образуется гидросульфат металла и азотная кислота:
LiNO3 + H2SO4(конц) → LiHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака.(каталитическое окисление аммиака) Процесс происходит в несколько стадий.
Особенности промышленного получения в том, что для производства важно найти дешевый исходный продукт(желательно природный) в достаточном количестве для получение больших объемов синтезируемого вещества. Для получения азотной кислоты такой продукт нашли- аммиак, который конверсируют из природного газа. Перед первой стадии тщательно очищают(фильтруют) как и аммиак от механических примесей, полученные в ходе его синтеза, так и сам воздух, которым будут окислять аммиак. Воздух поступает через заборную трубу далеко-далеко от предприятия.
Итак наконец-то первая стадия, она начинается в КОНТАКТНОМ АППАРАТЕ и представляет собой окисление аммиака потоками воздуха(кислородом), реакция ускоряется и идет легче благодаря катализаторам, например, сплав платины с палладием. В результате реакции азот окисляется до оксида азота(II) и выделяется теплота(экзотермическая реакция) как раз за счет нее поддерживается необходимая реакция для синтеза.
4NH3 + 5O2 → 4NO + 6H2O
Во второй стадии окисляют полученный оксид азота (II) до оксида азота(iV) в соотношении оксид:воздух 2:1 соответственно, что смещает равновесие преимущественно вправо. катализаторами на этой стадии являются температура от комнатной но не выше 50 градусов и давление 1,1 МПа. Процесс происходит почти сразу и без затруднений. Процесс проходит в ОКИСЛИТЕЛЬНОЙ башне.
2NO + O2 → 2NO2
На третьей стадии газовую смесь отправляют в ПОГЛОТИТЕЛЬНУЮ БАШНЮ, где у газа появляется возможность большей поверхностью соприкоснуться с поверхностью воды, для этого используют фарфоровые кольца. Смесь газа с водой происходит по принципу противоток: вода поступает сверху башни, а газ- снизу. Чтобы в результате не выделялся оксид азота(II), процесс проводят в избытке кислорода. Особенность в том, что процесс начинает идти медленнее по мере увеличения концентрации получаемой кислоты. Это конечная стадия процесса.
4NO2 + 2H2O + O2 → 4HNO3
Подробнее почитать про промышленное получение азотной кислоты можно в этой статье.
А)общие химические свойства кислот.
Азотная кислота – это сильная кислота. Азот в степени оксиления +5 проявляет сильные окислительные свойства .
1. Диссоциация и окрашивание индикаторов.
Азотная кислота практически полностью диссоциирует в водном растворе, в результате диссоциации образуется катион водорода и нитрат анион, за счет иона водорода происходит окрашивание индикаторов .
HNO3 → H+ + NO3–
1.1 окрашивание индикаторов: лакмус- красный, метиловый оранжевый — розовый, а фенолфталеин — бесцветный.
2. Азотная кислота проявляет свойства обычной кислоты в реакциях с основным и амфотермыми оксидами, основаниями и амфотерными гидроксидами, не проявляющими восстановительных свойств.
Например, азотная кислота взаимодействует с оксидом меди (II) с образованием нитрата меди(II) и воды, остальные реакции проходят аналогично с образованием нитрата металла (без изменения степени окисления металла и азота) и воды :
CuO + 2HNO3 → Cu(NO3)2 + H2O
2HNO3 + ZnO → Zn(NO3)2 + H2O
HNO3 + NaOH → NaNO3 + H2O
3HNO3 + Al(OH)3 → Al(NO3)3 + 3 H2O
3. Взаимодействует с солями, не проявляющими восстановительных свойств, т.е. азотная кислота в роли обычной кислоты, если соблюдается условия протекания реакция обмена(образуется слабый электролит, газ или осадок).
Например, азотная кислота взаимодействует с карбонатом натрия, в данной реакции образуется слабая угольная кислота, которая распадается на углекислый газ и воду-условие протекания реакции обмена соблюдается:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2(газ)
2HNO3 + CH3COOK→ KNO3 + CH3COOH(слабый электролит)
HNO3 + KHCO3 ⇒ KNO3 + H20 + CO2(газ)
2HNO3 + Na2SiO3 → 2NaNO3 + H2SiO3(осадок)
В реакциях с веществами, которые проявляют восстановительные свойства, азотная кислота ведет себя как сильный окислитель и участвует в ОВР. например:
1. оксид меди одновалентный при взаимодействии с азоткой окисляется до меди двухвалентной, а азот из высшей степени окисления переходит в оксид азота (IV), также выделяется вода.
Cu2O + 6HNO3 → 2Cu(NO3)2 + 2NO2 + 3H2O.
2 пример: оксид железа (II) окисляется до железа(III) и образуется бурый газ и вода.
FeO + 4HNO3 (конц.) → Fe (NO3)3 + NO2 + 2H2O.
3 пример: FeCl2 + 4 HNO3 → Fe(NO3)3 + 2 HCl + NO2 + H2O
в данном примере с хлоридом железа(II) ситуация аналогичная, только еще выделяется хлороводород.
4 пример: Na2SO3 + 2HNO3 → Na2SO4 + 2NO2 + H2O.
сульфит натрия переходит в сульфат, сера окисляется до максимальной степени окисления +6, выделяется бурый газ и вода.
5 пример: Соединения железа (II) азотная кислота окисляет до соединений железа (III), нитрата железа (III). в данной реакции выделяется молекулярная сера( так как мы используем в качестве реагента на азотную кислоту сульфид металла, т.е. серу в степени окисления -2), оксид азота (I) и вода:
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
Таким образом, заметим, что азотная кислота при взаимодействии с солями, которые проявляют восстановительные свойства(т.е. находятся не в высшей степени окисления, способные отдавать электроны, сами при этом окисляясь), сама восстанавливается до оксида азота(IV) и окисляет металлы и вещества в промежуточной степени окисления до максимальной степени окисления.
4. Азотная кислота активно взаимодействует с металлами.
В подобных реакциях водород никогда не выделяется!! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот в степени окисления +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 (зависит от концентрации кислоты и активности металла).
металл + HNO3 → нитрат металла + вода + продукт восстановления азотной кислоты(газ или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты, но если нагреть, то реакция пойдет. Азот восстанавливается до степени окисления +4(бурый газ), так же выделяется вода:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Платина и Золото с азотной кислотой НЕ реагирует, но они растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему), азот восстанавливается до +2(бесцветный газ, ядовит) :
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Азотная кислота высокой концентрации взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
Щелочные и щелочноземельные металлы взаимодействуют с нашей кислотой до образования оксида азота(I)(веселящий газ, используется для наркоза):
10HNO3 + 4Ca → 4Ca(NO3)2 + N2O + 5H2O
С неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия) азотная кислота может реагировать разбавленной. При этом образуется оксид азота (II).
8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
С активными металлами (щелочными и щелочноземельными(натрий, литий, кальций и др.), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота, при это образуется нитрат щелочного металла и вода:
12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Сильно разбавленная азотная кислота взаимодействует с активными металлами. в реакции образуется аммиак, который в избытке кислоты(т.е аммиак начинает взаимодействовать с избытком азотной кислоты) превращается в соль нитрат аммония. Обратите внимание: только в этом типе реакций НЕ выделяется газ!!!:
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Взаимодействие азотной кислоты с металлами можно представить в виде следующей таблички:

5. Неметаллы подвергаются окислению в результате взаимодействия с азотной кислотой (кроме кислорода, водорода, хлора, фтора и некоторых других).
В результате реакции кислота восстанавливается до NO или NO2, в то время как неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива(например угольная)).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3(конц) + S → H2SO4 + 6NO2 + 2H2O
2HNO3 (разб) + S → H2SO4 + 2NO
5HNO3(конц) + P → H3PO4 + 5NO2 + H2O
5HNO3(разб) + 3P + 2H2O → H3PO4 + 5NO
10HNO3 + I2 → 2HIO3 + 10NO + 4H2O
4HNO3 + C → CO2 + 4NO + 2H2O
6. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например, азотная кислота окисляет оксид серы (IV), в итоге образуется бурый раз и серная кислота:
2HNO3 + SO2 → H2SO4 + 2NO2
Второй пример: азотная кислота окисляет иодоводород до оксида азота(II) и йодноватой кислоты также выделяется вода :
6HNO3 + HI → HIO3 + 6NO + 3H2O
Сера в степени окисления -2(например сульфиды) окисляется без нагревания до простого вещества(сера), но если нагреть, то до серной кислоты:
2HNO3 + H2S → S + 2NO2 + 2H2O
При нагревании до серной кислоты:
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III), нитрата железа (III). в данной реакции выделяется молекулярная сера( так как мы используем в качестве реагента на азотную кислоту сульфид металла, т.е. серу в степени окисление -2), оксид азота (I) и вода:
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
7. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновая реакция является качественной реакцией на нитрат-анионы. При добавлении концентрированной азотной кислоты к раствору белка, содержащего ароматические аминокислоты, происходит денатурация белков и образование нитрозоаминов. При нагревании белка с нитрат-анионами происходит образование желтого цвета, который при добавлении избытка аммиака переходит в оранжевый цвет. Таким образом, ксантопротеиновая реакция может использоваться для обнаружения наличия нитрат-анионов в растворах. Подробнее про качественные реакции и аминокислоты читайте здесь.
Азотная кислоты используется для производства азотных удобрений, взрывчатых веществ, в качестве окислителя в ракетных двигателях, в органическом синтезе(производство красителе, лекарств, пластмасс, растворителей)
1)Выделение бурого газа при добавлении к веществу меди и конц.серной кислоты:
NaNO3 + H2SO4 —> NaHSO4 + HNO3
4HNO3 +Cu —>(to)Cu(NO3)2 +2NO2 +2H2O
2)Выделение аммиака при добавлении к веществу концентрированного раствора щелочи и цинковой пыли или алюминия:
KNO3+7KOH +4Zn +6H2O = NH3 + 4K2[Zn(OH)4]
1.Все нитраты(в различных условиях) проявляют свойства окислителей. Продукты восстановления азота определяются природой восстановителя и условиями проведения реакции:

2.Продукты разложения сухих нитратов металлов при нагревании зависят от положения металла в ряду положений:

Металлы отличаются от неметаллов перечнем свойств, о которых ниже и пойдёт речь.
В настоящее время известно 118 химических элементов, из которых 92 являются металлами.

В короткой Периодической таблице металлы находятся в начале периодов, а также в побочных подгруппах. Все элементы побочных подгрупп являются металлами. Условной границей, отделяющей металлы от неметаллов, служит диагональ бор — астат, левее и ниже которой все элементы относятся к металлам. Элементы, находящиеся вблизи диагонали, имеют двойственную природу.
Для металлов и их сплавов характерна металлическая кристаллическая решётка. Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны.
Между атомами в составе кристаллической решётки возникает металлическая химическая связь.

Сравнивая энергию различных типов химических связей, можно сделать вывод о прочности металлической связи:
| для молекулярной связи | 103 Дж/моль |
| для ионной | 105–107 Дж/моль |
| для металлической | 105–106 Дж/моль |
У металлов сравнительно большие радиусы атомов. На внешнем электронном слое у большинства металлов находится небольшое число электронов (от 1 до 3). Их наружный слой далёк до завершения. Металлам характерны низкие значения электроотрицательности (<2 по шкале Поллинга). Валентные электроны металлов слабо связаны с ядром и легко покидают атом.
Для того, чтобы приобрести электронную конфигурацию ближайшего инертного газа (а все элементы к этому и стремятся), металлам необходимо отдать один или два электрона, в зависимости от периода, в котором находится металл:
Li: [He]2s¹ Ca: [Ar]3s² Al: [Ne]3s²3p¹ Mg: [Ne] 3s2 K: [Ar] 4s1 Fe: [Ar] 3d6 4s2 Zn: [Ar] 3d10 4s2
Внешний энергетический уровень металла обуславливает его окислительно-восстановительные свойства, как и то, какую степень окисления металл способен принимать. Например, Li ⁺¹ Ca⁺² Al⁺3
1. Отсутствие цвета и характерный металлический блеск. Это объясняется высокой подвижностью электронов, имеющих разную скорость и энергию → электроны способны поглощать всю линию спектра (не окрашены). При снятии возбуждения электрона происходит излучение света (блеск).
2. Металлы обладают высокой электропроводностью и теплопроводностью. Это хорошо объясняется высокой подвижностью электронов, находящихся в составе металлической кристаллической решётки.
3. Вследствие большой прочности металлической связи металлы обладают высокими температурами плавления и значительной твёрдостью. (В металлах с низкой валентностью прочность связи ниже → эти металлы легкоплавкие и мягкие. Например, литий.)
4. Пластичность. Благодаря особенностям кристаллической решётки металлы в результате механического воздействия способны не разрушаться, образуя порошок, а менять форму.
5. Магнетизм. Создается неравномерным распределением электронов в атомах некоторых металлических элементов. Неравномерное вращение и движение, вызванное этим неравномерным распределением электронов, перемещает заряд внутри атома вперед и назад, создавая магнитные диполи.
Благодаря тому, что металлам проще лишиться электронов на своём внешнем энергетическом слое, в реакциях металлы-простые вещества будут выступать исключительно в роли восстановителей.
В зависимости от активности, металлы традиционно подразделяют на три группы: Li, K, Ba, Sr, Ca, Na, Mg, Al – активные металлы; Mn, Zn, Cr, Cd, Co, Ni, Pb – металлы средней активности; H2, Cu, Ag, Hg, Au, Pt – малоактивные металлы.
Чем активнее металл, тем проще он будет отдавать электроны → будет проявлять более сильные восстановительные свойства и первым взаимодействовать с окислителем.
| Активный металл | легко отдает электроны | сильные восстановительные свойства | взаимодействует с окислителями охотнее |
| Неактивный металл | тяжело отдает электроны | слабые восстановительные свойства | взаимодействует с окислителем менее охотно |
Металлы вступают в ОВР с простыми веществами-неметаллами, образуя бинарные соединения, в которых металл имеет положительную степень окисления, а неметалл — отрицательную.
2Na + Cl2 → 2NaCl
2Mg + O2 → 2MgO
Zn + S → ZnS
Вступают в реакцию: O2 (кроме благородных Me), Hal2, N2, S, P, C и др.
Li — единственный реагирует с азотом без нагревания с обр Li3N
Во взаимодействии щелочных металлов с кислородом есть особенность: все они, кроме лития, образуют пероксиды и надпероксиды.

4Li + O2 → 2Li2O (оксид)
2Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (надпероксид)
C жидкой водой взаимодействуют активные металлы. Результатом этой ОВР является образование щелочей.
2Na + H2O → 2NaOH + H2
Cu + H2O ↛
Металлы правее водорода (не активные) не вступают в реакцию с водой.
Те металлы, которые стоят в ряду активности левее водорода, способны вытеснять его, образуя с кислотным остатком соль.
Zn + 2HCl → ZnCl2 + H2
3Fe + 4H3PO4 → Fe3(PO4)4 + 6H2
Hg + H3PO4 ↛
Кислоты HNO3 и H2SO4 являются сильными окислителями за счет кислотного остатка и с металлами будут реагировать специфичнее (например, окислять неактивные металлы).
H2SO4(конц)
В разбавленном виде серная кислота является окислителем за счёт протона.
Продукты восстановления серной кислоты зависят от активности металла, с которым она реагирует.
H2SO4(конц)
+ активный Me (Li-Zn) → Соль + H2S⁻² + H2O
+ металл средней активности (Cd-Pb) → Соль + S⁰ + H2O
+ неактивный металл (после H2 и Fe) → Соль + S⁺⁴O2 + H2O
Более подробно о реакциях металлов с серной кислотой можно прочитать в статье.
HNO3
И разбавленные, и концентрированные растворы азотной кислоты являются окислителями за счёт атома N⁺⁵
Концентрированная азотная кислота даёт один продукт, для разбавленной тенденция образования продуктов реакции аналогична серной кислоте.
HNO3(конц) + Me(независимо от активности) → Соль + NO2 + H2O
HNO3(разб)
+ активный Me (Li-Zn) → Соль + N2⁰ + H2O
+ металл средней активности (Fe-Pb) → Соль + N2⁺¹O + H2O
+ неактивный металл (после H2 и Fe) → Соль + N⁺²O + H2O
HNO3(оч разб) + активный Me (Li-Zn) → Соль + N⁻³H4NO3 + H2O
Более подробно о реакциях металлов с азотной кислотой можно прочитать в статье.
Металлы способны вступать в реакцию с солями, вытесняя менее активный металл и образуя с кислотным остатком новую соль.
Ca + ZnCl2 → CaCl2 + Zn
K + CuI → KI + Cu
Fe + Mg(NO3)2 ↛

Особенностью амфотерных металлов (Be, Al, Zn и др) является их способность взаимодействовать как с кислотами, так и с щелочами с образованием комплексов.
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
Zn + 2NaOH + H2O → Na2[Zn(OH)4] + H2
При нагревании комплексы не образуются.
2Al + 2NaOH + 2H2O → 3H2 + 2NaAlO2 (алюминат натрия)
Be + 2KOH → H2 + 2NaAlO2 (бериллат калия)
Zn + 2KOH → 2H2 + K2ZnO2 (цинкат калия)
Характеристика меди как химического элемента
Медь — представитель d–элементов. Медь расположена в побочной подгруппе I группы. В основном состоянии атом меди имеет электронную конфигурацию [Ar]3d104s1 (за счет «проскока» электрона). В соединениях медь проявляет степени окисления +1 и +2:
Cu . . . 3d104s1 — 1e— Cu+1 . . . 3d10
Cu . . . 3d104s1 — 2e— Cu+2 . . . 3d9
Обе степени окисления являются устойчивыми.
Физические свойства меди. Важнейшие сплавы меди
Медь имеет красноватую окраску. Медь — мягкий, пластичный, ковкий металл, обладает высокой тепло- и электропроводностью. Высокая теплопроводность меди обусловливает её использование для изготовления проводов. К важнейшим сплавам меди относятся бронза ( 10% олова), мельхиор (30 % никеля), латунь (40 % цинка), нейзильбер ( 20% цинка, 15% никеля).
Получение меди
В природе медь встречается в виде сульфидов, например халькопирита , ковеллина , халькозина , и осно́вных карбонатов меди(II), например малахита и азурита . В процессе получения меди сульфидную руду сначала обжигают и получают оксид меди(II), который затем восстанавливают углём или природным газом:
Cu2S + 2O2 = 2CuO + SO2
CuO + C = Cu + CO
Медь, используемую в электротехнике, очищают с помощью электрохимического рафинирования. Медный слиток помещают в гальваническую ванну с раствором сульфата меди(II) и проводят электролиз с растворимым анодом, которым является загрязнённая медь, катодом служит графитовый стержень. В процессе электролиза медный анод растворяется, а на катоде оседает чистая медь. Содержащиеся в меди примеси остаются в растворе, а часть из них — анодный шлам — оседает на дно электролитической ванны.
Химические свойства меди
Химическая активность меди не высока. В ряду активности металлов медь расположена правее водорода поэтому не может вытеснить водород из растворов неокисляющих кислот (все кроме концентрированной серной и азотной любых концентраций).
В сухом воздухе медь практически не окисляется, с водой не реагирует. При нагревании медь взаимодействует с кислородом и в зависимости от условий образует различные оксиды:
2Cu + O2 = 2CuO ( 400-5000C, избыток кислорода) — оксид меди(II)
4Cu + O2 = 2Cu2O (t > 5000C, недостаток кислорода) — оксида меди(I)
При взаимодействии с серой медь способна к образованию двух сульфидов: при 4000C образуется сульфид меди(II):
Cu + S = CuS ( t=4000C)
а при температуры выше — сульфид меди(I):
2Cu + S = Cu2S ( t > 4000C)
При нагревании с фтором, хлором, бромом медь образует галогениды меди(II):
Cu + Br2 = CuBr2
а с иодом — иодид меди (I): (т.к. йод является весьма слабым окислителем). Далее мы рассмотрим реакции ОВР между соединениями меди(II) и йодид-ионами.
2Cu + I2 = 2CuI
Медь не реагирует с водородом, азотом, углеродом и кремнием.
Так как в электрохимическом ряду напряжений металлов медь расположена после водорода, то она не взаимодействует с разбавленными соляной и серной кислотами. Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей:
(данная реакция в рамках ЕГЭ НЕ рассматривается)
2Cu + 4HCl + O2 = 2CuCl2 + H2O
Важно запомнить: писать реакцию металлической меди с минеральными кислотами без участия кислорода — нельзя!
С разбавленной азотной кислотой медь реагирует с образованием нитрата меди(II) и оксида азота(II):
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4H2O
С концентрированными серной и азотной кислотами медь взаимодействует с образованием солей меди(II) и продуктов восстановления кислот — SO2 и NO2 соответственно:
Cu + 2H2SO4(конц) = CuSO4 + SO2 + 2H2O (при нагревании)
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O
Медь окисляется под действием таких окислителей, как оксид азота(IV) , оксид серы(IV) , хлорид железа(III) :
4Cu + 2NO2 = 4CuO + N2
4Cu + SO2 = Cu2S + 2CuO
Cu + 2FeCl3 = CuCl2 + 2FeCl2
При этом в реакции 1. Медь будет окислятся до +2, в то время как, оксид азота(IV) восстановится до азота 0. В реакции 2. медь окислится до +1 и +2, сера +4 восстановится до серы -2. В реакции 3 медь окислится до +2, а железо восстановится с +3 до +2.
Последнюю реакцию используют в электротехнике для травления плат.
Во влажном воздухе в присутствии углекислого газа медь покрывается зелёным налётом гидроксокарбоната меди(II):
2Cu + H2O + CO2+ O2 = (CuOH)2CO3
Соединения меди(I)
Оксид меди(I) и соответствующий ему гидроксид проявляют основные свойства; в воде не растворяются.
Для соединений меди(I) характерна окислительно-восстановительная двойственность, они могут восстанавливаться до металлической меди и окисляться до соединений меди(II), а также подвергаются диспропорционированию. Например:
Cu2O + CO = Cu + CO2 (Cu+1 восстанавливается)
CuCl + 3HNO3 = Cu(NO3)2 + HCl + NO2 + H2O (Cu+1 окисляется)
Cu2O + H2SO4(концентр) = CuSO4 + Cu + H2O (Cu+1 диспропорционирует)
Соединения меди(II)
Соединения меди(II) по сравнению с соединениями меди(I) более распространены. Оксид меди(II) и гидроксид меди(II) обладают основными свойствами. Проявляя основные свойства, они реагируют с кислотами с образованием соответствующих солей меди(II):
CuO + H2SO4 = CuSO4 + H2O
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Примечание: Несмотря на то что оксид меди(II) и соответствующий гидроксид проявляют также и кислотные свойства ( иначе говоря обладают амфотерными свойствами), в рамках ЕГЭ эти соединения рассматриваются только как основные. Ниже рассмотрены кислотные свойства в сугубо ознакомительных целях.
Кислотные свойства оксида меди(II) проявляются при его сплавлении с оксидами щелочных металлов, в результате чего образуются купраты:
CuO + Na2O = Na2CuO2
Гидроксид меди(II) проявляет кислотные свойства при взаимодействии с концентрированными растворами щелочей, образуя комплексные купраты голубого цвета:
Cu(OH)2 +2KOH = K2[Cu(OH)4]
Гидроксид меди(II) в виде студнеообразного осадка голубого цвета получают при действии разбавленных растворов щелочей на растворимые соли меди(II):
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
При нагревании гидроксид меди(II) разлагается на оксид меди(II) чёрного цвета и воду:
Cu(OH)2 = CuO + H2O
Из солей меди(II) наиболее известен медный купорос — кристаллическое вещество синего цвета. Медный купорос применяют при крашении тканей, для протравливания семян, консервирования древесины, в качестве пестицида. При добавлении раствора медного купороса к известковому молоку получают бордосcкую жидкость, которая используется для борьбы с вредителями сельского хозяйства.
При действии на раствор сульфата меди(II) раствором карбоната натрия выпадает бледно-голубой осадок основного карбоната меди(II) , который через некоторое время приобретает зелёный цвет. Основный карбонат меди(II) известен под названием малахит, который встречается в природе. При нагревании малахит разлагается:
(CuOH)2CO3 = 2CuO + H2O + CO2
Соединения меди(II) проявляют окислительные свойства, восстанавливаясь при этом до соединений меди(I) при взаимодействии со слабыми восстановителями:
2CuSO4 + 4KI = 2CuI + I2 +2K2SO4
2CuCl2 + SO2 + 4NaOH = 2CuCl + Na2SO4 + 2NaCl + 2H2O
При этом восстановители будут окисляться до устойчивой степени окисления или до металлической меди с сильными восстановителями:
CuSO4 + Fe = Cu + FeSO4
CuO + H2 = Cu + H2O
Многие соединения меди окрашены: CuO и сульфиды чёрные, Cu2O— красный, Cu(OH)2— голубой; практически все безводные соли меди(II) белые, а их кристаллогидраты и водные растворы имеют голубую или зелёную окраску.
Изменение окраски соединений меди(II) при переходе в соединения меди(I) используется в органической химии для качественного анализа, например для обнаружения альдегидов.
Свежеосажденный голубого цвета восстанавливается альдегидами, в результате чего образуется осадок гидроксида меди(I) жёлтого цвета, который при слабом нагревании распадается на воду и оксид красного цвета:
CH3CHO + 2Cu(OH)2 = CH3COOH + 2CuOH + H2O
(жёлтый)
2CuOH = Cu2O + H2O
(красный)
Реакции комплексообразования для соединений меди
Данный материал в рамках ЕГЭ на данный момент не рассматривается.
С концентрированными хлороводородной, бромоводородной и иодоводородной кислотами медь реагирует с образованием комплексного соединения — дихлоркупрата(I) водорода и выделением водорода:
2Cu + 4HCl = 2H[CuCl2] + H2
Медь растворяется в водном растворе аммиака в присутствии кислорода воздуха с образованием ярко-синего раствора гидроксида тетраамминмеди(II):
2Cu + 8NH3 + 2H2O + O2 = 2[Cu(NH3)4](OH)2
Медь в степени окисления образует нерастворимые соли , а также растворимые комплексы, например хлорид диамминмеди(I) и гидроксид диамминмеди(I) , которые можно получить растворением в аммиаке хлорида меди(I) и оксида меди(I) соответственно:
CuCl + 2NH3 = [Cu(NH3)2]Cl
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
Гидроксид меди(II) растворяется в аммиаке с образованием комплекса ярко-синего цвета:
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Характеристика серебра как химического элемента
Серебро, как и медь, представитель – d элементов. Серебро расположено в побочной подгруппе I группы. В основном состоянии атом серебра имеет электронную конфигурацию[Kr]4d105s1 (за счёт «проскока» электрона). Для серебра наиболее характерна степень окисления +1 .
Серебро известно человечеству с глубокой древности. В природе серебро встречается как в самородном состоянии, так и в виде соединений.
Физические свойства серебра
Чистое серебро — мягкий и ковкий металл, легко прокатывается в фольгу и вытягивается в проволоку, обладает прекрасной тепло- и электропроводностью. Серебро широко используется для изготовления ювелирных изделий, однако для этих целей применяют не чистое серебро, а его сплавы –875й пробы (87.5 % серебра) или 925й пробы (92.5 % серебра). Это связано с тем, что сплавы, сохраняя окраску металла, обладают большей твёрдостью.
Химические свойства серебра
С химической точки зрения серебро достаточно инертно (в ряду химической активность находится правее водорода и меди). Серебро не реагирует с кислородом, однако при длительном хранении на воздухе в присутствии влаги чернеет, так как вступает в реакцию с содержащимся в нём в небольших количествах сероводородом:
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Именно этот процесс обусловливает потемнение серебряных изделий. Как и медь, серебро не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах-окислителях:
2Ag + 2H2SO4(конц) = Ag2SO4 + SO2 + 2H2O
Ag + 2HNO3(конц) = AgNO3 + NO2 + H2O
3Ag + 4HNO3(разб) = 3AgNO3 + NO + 2H2O
Соединения серебра(I)
Оксид серебра(I) в виде коричневого осадка получают, действуя щелочами на растворимые соли серебра:
2AgNO3 +2NaOH = Ag2O + 2NaNO3 + H2O
Оксид серебра(I) проявляет основные свойства и взаимодействует с кислотами:
Ag2O + 2HNO3 = 2AgNO3 + H2O
Осадок оксида серебра(I) легко растворяется в водном растворе аммиака с образованием бесцветного раствора гидроксида диамминсеребра(I), который называют «аммиачным раствором оксида серебра»:
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH
Этот раствор применяют в органической химии для качественного определения альдегидной группы (реакция «серебряного зеркала»):
2[Ag(NH3)2]OH + CH3CHO = 2Ag + CH3COONH4 + 3NH3 + H2O
Серебро в степени окисления +1 в этой реакции проявляет окислительные свойства.
Наибольшее значение среди солей серебра имеет нитрат серебра , который называется также ляписом. Водный раствор нитрата серебра имеет нейтральную реакцию среды, что указывает на практически полное отсутствие гидролиза этой соли. Нитрат серебра прекрасно растворяется в воде: при 20oC в 100 г воды растворяется 223 г соли, а при 100oC— 770г. При нагревании нитрат серебра разлагается:
2AgNO3 = 2Ag + NO2 + O2
Ляпис находит применение в медицине благодаря прижигающему и дезинфицирующему действию.
Все галогениды серебра, кроме фторида , не растворяются в воде. Хлорид серебра имеет белый цвет, бромид — светло-жёлтый, иодид — жёлтый. Галогениды серебра светочувствительны, что находит применение в фотографии.
Нерастворимые галогениды серебра, как и его оксид, можно перевести в раствор действием аммиака или цианидов вследствие образования растворимых комплексов:
AgCl + 2NH3 = [Ag(NH3)2]Cl
AgI + 2KCN = K[Ag(CN)2] + KI
Ионы серебра даже при очень низком содержании их в растворе способны убивать болезнетворные бактерии, что обусловливает целебное действие воды, в которую были погружены серебряные предметы.
Серебро используется в производстве зеркал, аккумуляторов, изготовлении монет, столовой посуды, ювелирных изделий, электрических контактов, микросхем и др.
Выводы по курсу:
Это элемент побочной подгруппы 7 группы 4 периода периодической
системы химических элементов Д. И. Менделеева с атомным номером 25.
Обозначается символом Mn. Электронная структура внешнего
энергетического уровня его атома выражается формулой 3d 5 4s 2 . Марганец —
металл, поэтому не может находиться в отрицательных степенях окисления.
Высшая степень окисления = № группы=7. Для него характерны степени
окисления +2, +4 и +6, менее устойчивы соединения, в которых марганец
находится в степени окисления +3. Mn(2+) проявляют основные свойства,
Mn(+4) — амфотерные, Mn(+6) и Mn(+7) — кислотные.
Получение
1.Алюмотермия:
3MnO2+4Al=2Al2O3+3Mn
2.Восстановсление коксом:
MnO2+2C=Mn+2CO
3.Электролиз солей:
2MnSO 4+2H2O=2Mn +O2+2H2SO4
Подробнее про электролиз можно почитать в этой статье:
Химические свойства металла
1.Взаимодействие с водой:
а)при обычных условия не реагирует
б)при нагревании реагирует с образованием основного оксида с выделением
Н2:
Mn+2H2O=Mn(OH)2+H2
2.Взаимодействие с кислотами-неокислителями:
Mn+2HCl(разб)=MnCl2+H2
Mn+2H2SO4(разб)=MnSO4+2H2
Mn находится в ряду активности металлов до водорода, поэтому может
вытеснять его из растворов кислот.
3.Взаимодействие с кислотами-окислителями:
Mn в свободном виде проявляет восстановительные свойства, окисляясь до
Mn(2+):
Mn+2H2SO4 (конц)=MnSO4+SO2+2H2O
3Mn+8HNO3 (разб)=3Mn(NO3)2 +2NO+4H2O
Mn+4HNO3 (конц)=Mn(NO3)2+2NO2+2H2O
Подробнее про продукты восстановления кислот-окислителей можно
почитать в статьях про азотную кислоту и серную кислоту.
4.Окисление неметаллами:
а)кислородом:
При окислении на воздухе Mn пассивируется, на поверхности металла
образуется прочная оксидная пленка:
Mn+O2=MnO2
б)Галогенами:
Mn+F2=MnF2
Mn+Cl2=MnCl2
Mn+Br2=MnBr2
Mn+I2=MnI2
в) С другими неметаллами при нагревании:
3Mn +N2=Mn3N2
3Mn +C=Mn3C
2Mn+Si=Mn2Si
3Mn+2P=Mn3P2
Соединения марганца (II)
При действии сильных окислителей ион Mn2+ способен переходить в ион
Mn7+:
MnSO4+PbO2+HNO3=HMnO4+PbSO4+Pb(NO3)2+H2O
MnSO4+Br2+4KOH=MnO2+2KBr+K2SO4+2H2O
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет,
превращаясь в оксид-гидроксид марганца (IV).
Mn(OH)2+O2=MnO2+H2O
Оксид MnO
Имеет зеленую окраску, нерастворим в воде.
Химические свойства:

1.Основные свойства:
а)Взаимодействие с кислотами с образованием соответствующих солей:
MnO+2HCl=MnCl2+H2O
б)Взаимодействие с кислотными оксидами с образованием соответствующих
солей:
MnO+SiO2=MnSiO3
2.Восстановительные свойства:
2MnO+O2=2MnO2
Способы получения
1.Разложением солей и основания двухвалентного Mn при нагревании:
MnCO3=MnO+CO2
2.Восстановлением четырёхвалентного оксида Mn различными
восстановителями при нагревании:
MnO2+H2=MnO+H2O
MnO2+CO=MnO+CO2
MnO2+C=MnO+C
Химические свойства Mn(OH)2

1.Разложение при нагревании:
Mn(OH)2=MnO+H2O
2.Основные свойства:
Взаимодействие с кислотами с образованием соответствующих солей:
Mn(OH)2+2HCl=MnCl2+H2O
3.Восстановительные свойства: ярко выражены в щелочной среде
4Mn(OH)2+O2=4MnO(OH)+2H2O
Mn(OH)2+Br2+2KOH=MnO2+2KBr+2H2O
При действии сильных окислителей в нейтральной среде:
Mn(OH)2+H2O2=MnO2+H2O
Mn(OH)2+Br2=MnO2+2HBr
В результате образуется бурый осадок гидроксида марганца (4)
Соединения марганца (+4)
Оксид MnO2
Это темно-бурое нерастворимое в воде вещество, наиболее устойчивое
кислородное соединение марганца при обычных условиях.

Химические свойства
1.Амфотерные свойства:
а)Кислотные свойства выражены сильнее
Взаимодействие со щелочами при сплавлении с образованием
манганатов:
MnO2+2NaOH=Na2MnO3
б)Щелочные свойства выражны очень слабо: при взаимодействии с
концентрированной H2SO4 выделяется крайне неустойчивую соль Mn(SO4)2
2.Окислительные свойства более отчётливо проявляются в кислой среде,
окисляют как сильные, так и слабые восстановители:
MnO2 +4HCl =MnCl2+Cl2+2H2O
MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
MnO2+KNO2+H2SO4=MnSO4+KNO3+H2O
3.Окислительные свойства:
Действием более сильных окислителей MnO2 может быть окислен до
соединений Mn (VI), Mn (VII):
2MnO2+2KOH+KNO3=K2MnO4+H2O+KNO2
Соединения марганца (+6)
Манганаты
K2MnO4 − манганат калия, соль не выделенной в
свободном состоянии марганцовистой кислоты H2MnO4. Не
получен и оксид Mn (VI) – MnO3. Растворы манганатов
окрашены в темно-зеленый цвет, присущий ионам
MnO42−. Они устойчивы только в сильнощелочной среде.
Химические свойства
1.Диспропорционирование при разбавлении раствора водой
3K2MnO4+2H2O=2КMnO4+MnO2+4KOH
Данная реакция протекает, так как для марганца более устойчивыми
степенями окисления являются +4 и +7, чем +6.
2.Окислительные свойства:
K2MnO4+8HCl(конц)=MnCl2+2Cl2+2KCl+4H2O
3.Восстановительные свойства:
K2MnO4+Сl2 =2КMnO4+2KCl
Соединения марганца (+7)
Оксид марганца (VII) Mn2O7 – зеленовато-черная жидкость, сильный
окислитель. Растворим в воде.
Химические свойства
Кислотные свойства: взаимодействие с водой с образованием
соответствующей кислоты:
Mn2O7+H2O=2HMnO4
Перманганаты
Окислительные свойства

Продукт восстановления зависит от среды, в которой протекает реакция:
а)кислая среда:
2KMnO4+16HCl(конц)=2MnCl2+5Cl2+2KCl+8H2O
2KMnO4+5H2O2+3H2SO4=2MnSO4+5O2+K2SO4+8H2O
б)Нейтральная среда:
2KMnO4+5KI+H2O=2MnO2+KIO3+2KOH
в)Щелочная среда:
Проявляют довольно слабые окислительные свойства и способны окислить
только сильные восстановители:
2KMnO4+K2SO3+2KOH=2K2MnO4+K2SO4+H2O
2KMnO4+2KI=2K2MnO4+I2
Новости
22.11.2024
22.11.2024
24.10.2024
14.10.2024
09.10.2024
01.10.2024