Электронная конфигурация углерода. Основное и возбуждённое состояние.
В настоящее время известно более 30 миллионов органических соединений и причина такого многообразия кроется в особенностях атома углерода, связанных с его электронным строением.
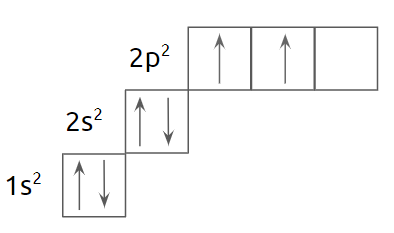
Углерод – 6 элемент Периодической Системы. Заряд ядра атома углерода равен +6. Значит, всего электронов тоже 6. Два электрона будут располагаться на первом уровне, а четыре на втором (внешнем) уровне. Электроны, находящиеся на внешнем энергетическом уровне углерода, способны к образованию химических связей и называются валентные. Таким образом, внешний уровень атома углерода содержит четыре валентных электрона. В невозбуждённом состоянии два из них являются спаренными, а два — неспаренными.
На внешнем уровне мы видим одну полностью заполненную орбиталь, её оставляем в покое, обратим внимание на две орбитали с неспаренными электронами и одну пустую, именно на них возможно образование связи: видим, что больше трёх электронов такой углерод не способен присоединить. В невозбуждённом (основном) состоянии углерод может образовать три ковалентные связи, значит, его валентность равна трём.
Однако при поглощении энергии электроны внешнего уровня атома углерода распариваются и атом переходит в возбуждённое состояние, в котором на внешнем уровне содержится 4 неспаренных электрона. В возбуждённом состоянии атом углерода может образовать четыре ковалентные связи.
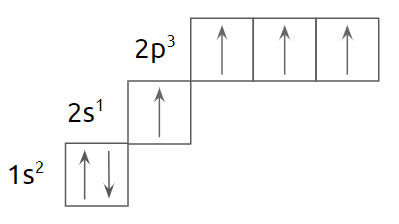
Получается, что электроны не равны по энергии (1 электрон на 2s-подуровне и 3 электрона на 2p-подуровне), следовательно, одна из связей должна носить другой характер. Однако, рассматривая молекулу метана, видим четыре равноценные связи — длина каждой 1,54 Å.
Для объяснения этого факта была разработана теория гибридных состояний атома углерода.
Теория гибридизации атомных орбиталей углерода
Принято считать, что в истинных соединениях электроны распределены не на «простых» s- и p-орбиталях, а на смешанных или гибридных орбиталях.
Гибридные орбитали – результат объединения (комбинации) s- и p-орбиталей. Форма любой гибридной орбитали представляет собой несимметричную объёмную восьмёрку, в центре которой ядро атома, справа большая доля, а слева – малая.
Первое гибридное состояние углерода – sp3-гибридизация.
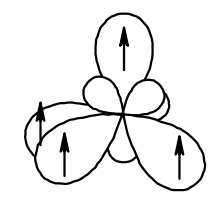
Гибридизация с участием одной s-орбитали и трёх p-орбиталей. В результате образуется четыре равноценные по форме и энергии sp3-гибридные орбитали.
Четыре гибридные орбитали образуют собой тетраэдр, угол между ними составляет 109о.
Углерод в состоянии sp3-гибридизации находится в молекуле метана СН4. Рассмотрим её строение. Изобразим четыре гибридные орбитали атома углерода в форме объёмной неправильной восьмёрки, на каждую из них поместим электрон. Четыре атома водорода имеют по одной сферической s-орбитали с одним электроном на ней. Молекула имеет форму тетраэдра, в его углах – водороды, а в центре – углерод. Связи между углеродом и водородом представляет собой перекрытие sp3-гибридной орбитали атома углерода и s-орбитали атома водорода, такой вид перекрытия называется σ-связью (сигма-связью).
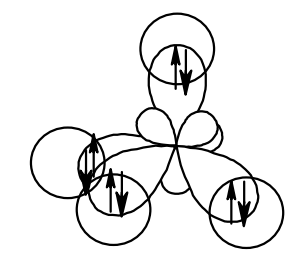
Подытожим, если углерод связан с четырьмя атомами посредством одинарных σ-связей – это sp3-гибридизованный углерод.
Второе гибридное состояние углерода – sp2-гибридизация.
Гибридизация с участием одной s-орбитали и двух p-орбиталей. В результате образуется три равноценные по форме и энергии sp2-гибридные орбитали и остаётся одна p-орбиталь, не подвергающаяся гибридизации.
Три гибридные орбитали образуют собой правильный треугольник, угол между ними составляет 120о.
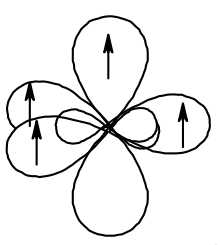
Углерод в состоянии sp2-гибридизации находится в молекуле этена СН2=СН2. Рассмотрим её строение. Изобразим три гибридные орбитали атома углерода в форме объёмной неправильной восьмёрки, для каждого атома углерода расположим негибридизованную p-орбиталь перпендикулярно плоскости «треугольника», на каждую из орбиталей поместим электрон. Четыре атома водорода имеют по одной сферической s-орбитали с одним электроном на ней. В молекуле этена 5 сигма-связей. Оставшиеся две негибридизованные p-орбитали параллельны друг другу и тоже перекрываются, в результате бокового перекрывания этих орбиталей образуется π-связь (пи-связь). Двойная связь в молекуле этена представляет собой сочетание одной σ-связи одной π-связи.
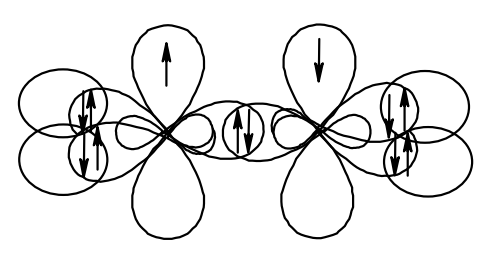
Таким образом, если углерод связан с тремя атомами и молекула содержит в своём составе двойную связь – это sp2-гибридизованный углерод.
Третье гибридное состояние углерода – sp-гибридизация.
Гибридизация с участием одной s-орбитали и одной p-орбитали. В результате образуется две равноценные по форме и энергии sp-гибридные орбитали и остаётся две p-орбитали, не подвергающиеся гибридизации.
Две гибридные орбитали лежат в одной плоскости, образуя угол 180о.
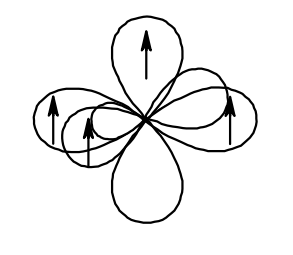
Углерод в состоянии sp-гибридизации находится в молекуле этина СН≡СН. Рассмотрим её строение. Изобразим две гибридные орбитали атома углерода в форме объёмной неправильной восьмёрки. Четыре негибридизованные р-орбитали (для каждого атома углерода по две) располагаются взаимно перпендикулярно. Два атома водорода имеют по одной сферической s-орбитали с одним электроном на ней. В молекуле этена 3 сигма-связи. Оставшиеся четыре негибридизованные p-орбитали посредством бокового перекрывания образуют две π-связи. Тройная связь в молекуле этина представляет собой сочетание двух π-связей (πz и πx) и одной σ-связи.
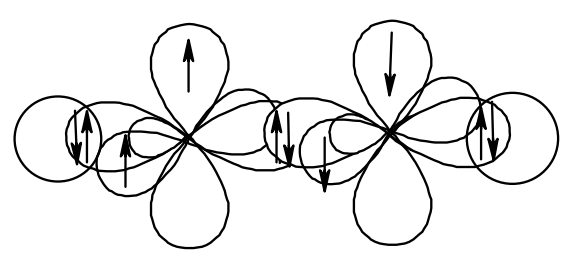
Итак, если углерод связан с двумя атомами и молекула содержит в своём составе тройную связь – это sp-гибридизованный углерод.
Основные положения теории Бутлерова.
Основой органической химии по праву можно считать «Теорию химического строения», разработанную русским химиком Александром Михайловичем Бутлеровым. Для знакомства с ней рассмотрим основные положения:
Первое положение
Химическое строение или химическая структура – строго определенная последовательность химического связывания атомов в молекулах веществ.
Формулы, отражающие последовательность атомов в молекуле, называют структурными, химические связи между атомами принято изображать с помощью чёрточек.
Второе положение
Свойства органических веществ зависят как от элементного состава соединения, так и от его строения: атомы в молекуле оказывают друг на друга взаимное влияние.
Третье положение
Бутлеров вводит и определяет одно из важнейших в органической химии понятий «изомерия»
Изомерия – это явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Изомерия делится на два вида: структурную и пространственную.
Структурная включает в себя изомерию
- углеродного скелета
обусловлена различным порядком связи между атомами углерода, за счет которых образуется скелет молекулы: если углерод в цепи связан с одним атомом углерода, он называется первичным, с двумя – вторичным, с тремя – третичным, с четырьмя – четвертичным.
Например, молекула бутана имеет линейное строение, а молекула изобутана – разветвлённое.
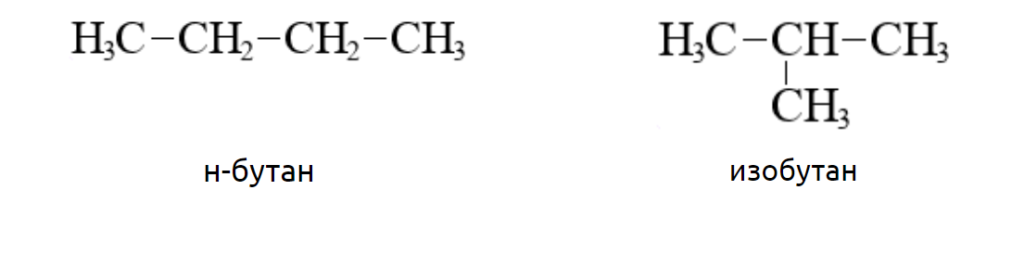
- положения кратной связи
обусловлена различным положением кратной связи при одинаковом углеродном скелете молекулы.
Например, двойная связь в молекуле бутена-1 располагается между первым и вторым атомами углерода, а в молекуле бутена-2 двойная связь – между вторым и третьим.
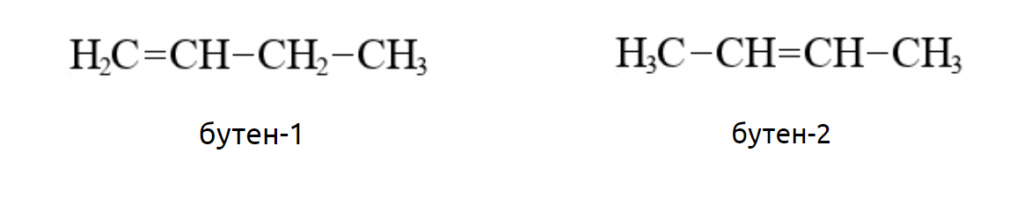
- положения функциональных групп
обусловлена различным положением функциональной группы или заместителя при одинаковом углеродном скелете молекулы.
Например, функциональная группа спиртов OH- в бутаноле-1 связана с первым атомом углерода, в бутаноле-2 со вторым.
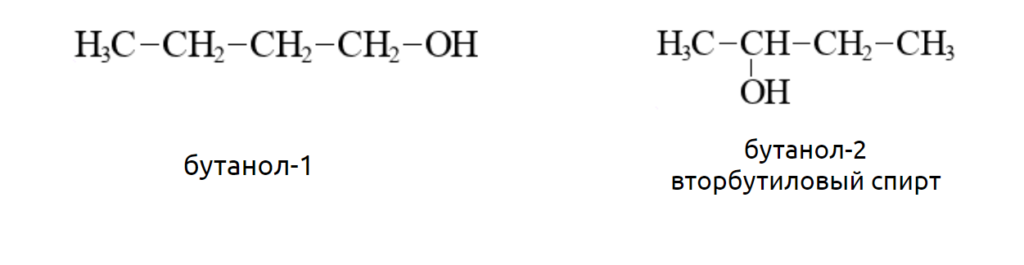
- межклассовая изомерия
обусловлена различным сочетанием и положением атомов в молекулах веществ, имеющих одинаковый химический состав (молекулярную формулу), но принадлежащих к различным классам.
Например, молекула бутена-1, принадлежащего к классу алкенов, и молекула циклобутана, принадлежащего к классу циклоалканов, обе имеют состав C4H8
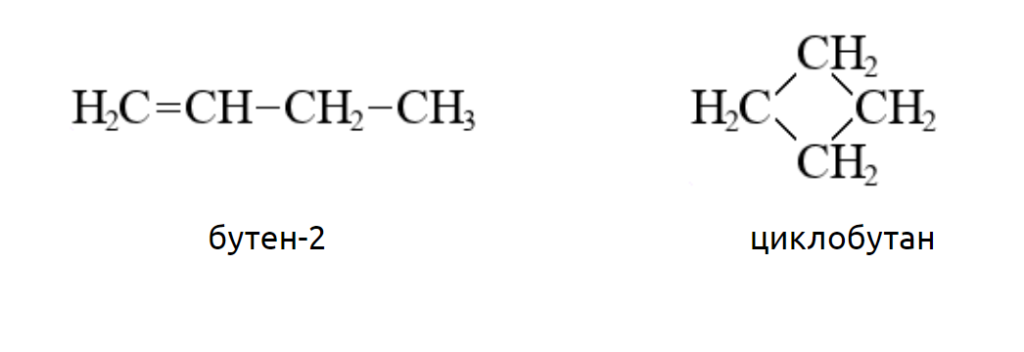
Пространственная в свою очередь делится на:
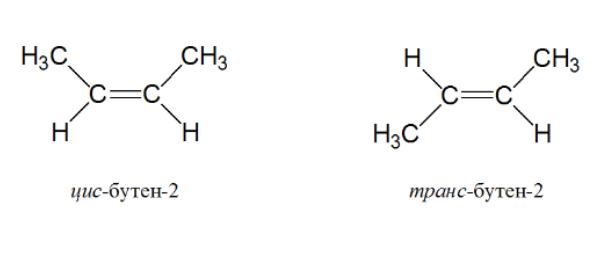
- геометрическую (цис-, транс-изомерия)
обусловлена существованием геометрических изомеров, отличающихся друг от друга характером взаимного расположения заместителей относительно двойной связи.
Например, в молекуле цис-бутена-2 метильные группы располагаются в одной плоскости, а в молекуле транс-бутена-2 – в разных: одна сверху, относительно двойной связи, другая – снизу.
- оптическую
обусловлена существованием энантиомеров – изомеров, которые соотносятся друг к другу как предмет и несовместимое с ним зеркальное отражение.
Четвёртое положение
исследовать строение органического вещества можно с помощью химических превращений, то есть исследование продуктов химической реакции может помочь определить строение исходных веществ.
Теория Бутлерова является по сей день господствующей теорией органической химии. Она не только объясняет строение и свойства всех известных органических соединений, но, как и Периодическая система элементов, позволяет на основании закономерностей предсказывать строение и свойства ещё неизвестных органических соединений. Также способы их синтеза – получения химических соединений из составных частей путём химической реакции.




