Строение аминокислот
Особенность строения аминокислот заключается в том, что они одновременно содержат две функциональные группы: карбоксильную (-СООН) и аминогруппу(-NH2). Две функциональные группы могут быть связаны как с разными, так и с одним атомом углерода.
Номенклатура аминокислот
Необходимо придерживаться следующих правил:
1. Для систематической нумерации ведут отсчет атомов углерода, начиная с атома, связанного с карбоксильной группой (1,2,3 соответственно). В рациональной нумерации сам атом углерода, связанный с карбоксильной группой, в нумерации не участвует (α, β, γ-соответственно).


2. Приставка амино-
3. Радикалы и их местоположение
4. Корень- показывает количество атомов углерода
5. Суффиксы -ан -ен -ин — показывают кратность связей
6. -Овая кислота
Существует множество аминокислот, 20 из них участвуют в генетическом коде. Важнейшие аминокислоты имеют специальные названия и обозначения, например : Глицин-аминоуксусная кислота (GLY)
Все природные аминокислоты являются α -аминокислотами. Перечень встречающихся в природе аминокислот не ограничен лишь аминокислотами, встречающимися в белках. Многие аминокислоты были выделены из растений или найдены в организмах животных. Первой выделенной природной аминокислотой был аспарагин. Он был выделен из сока спаржи.
Изомерия аминокислот
а) Изомерия положения функциональных групп

б) Изомерия углеродного скелета

в) Оптическая изомерия

Способы получения аминокислот
а) Галогенирование карбоновых кислот и последующий аммонолиз

б) Гидролиз пептидов

Физические свойства аминокислот
Аминокислоты-бесцветные кристаллические вещества. Причиной служит образование цвиттер-ионов.
В твердом виде и в водном растворе алифатические аминокислоты существуют в виде смеси цвиттер-ионов катионной и анионной формы , находящейся в состоянии равновесия. Положение равновесия зависит от рН среды и строения аминокислоты.
Аминокислоты хорошо растворяются в воде, плохо растворяются в неполярных растворителях (бензол, толуол, хлороформ).
Аминокислоты обладают высокими температурами плавления. Многие обладают сладким вкусом. Например, таблетки глицина.
Химические свойства аминокислот

В составе аминокислоты есть несколько реакционных центров: аминогруппа, отвечающая за основные свойства; карбоксильная группа, отвечающая за кислотные свойства. Исходя из вышесказанного мы делаем вывод, что аминокислоты являются амфотерными соединениями.
Углеродный скелет тоже относится к реакционным центрам и в зависимости от кратности связей углерод-углерод может отвечать определенным химическим свойствам:
а) если все связи углеродного скелета одинарные, то он может взаимодействовать с галогенами –реакции замещения;
б) если углеродный скелет содержит двойные или тройные связи, то могут происходить реакции присоединения ( можно присоединять: водород, воду, галогены, галогеноводороды);
Подробнее химические свойства каждого реакционного центра представлены в таблице:
| Аминогруппа | Карбоксильная группа | Предельная углеродная цепь | Непредельная углеродная цепь |
| Основные свойства | Кислотные свойства | Реакции замещения | Реакции присоединения |
| +Кислота | +Me(до Н2)=соль+Н2 | +Галогены | +H2 |
| +MeO=соль+Н2О | +H2O | ||
| +MeOH=соль+Н2О | +Галогены | ||
| +Соль=кислота`+соль ` | +Галогеноводороды | ||
| +Спирт=сложный эфир+Н2О |
а) Взаимодействие с кислотами: происходят реакции присоединения, например, при реакции глицина с соляной кислотой образуется хлорид карбоксиметиламмония (хлорид глициния)
б) Взаимодействие со спиртами: образование сложного эфира и воды
в) Взаимодействие с нитритом натрия в кислой среде: реакция идет с образованием молочной кислоты

г) Аминокислоты также взаимодействуют между собой с образованием пептидной связи
Таким образом получают такие соединения, как белки (пептиды). К такому типу относится известная реакция образования капрона. Для производства капрона используют производные аминокислот, а именно капролактам, который образуется за счет внутримолекулярной дегидратации 6-аминогексановой кислоты.
Что такое белки?
Белки- это органические соединения, состоящие из аминокислот, связанных между собой пептидной связью
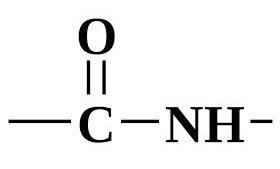
Химические свойства белков
Белки, как и входящие в их состав аминокислоты, обладают амфотерными свойствами.
а) При нагревании происходит сворачивание ( денатурация )белков;
б) Осаждение белков: обратимое (высаливание) и необратимое (денатурация) ;
в) Гидролиз белка ( под действием ферментов или при нагревании в кислой среде);

Качественные реакции
а) Биуретовая реакция (добавляем к раствору белка CuSO4+KOH)- яркое сине-фиолетовое окрашивание

б) Ксантопротеиновая реакция (добавляем HNO3)-Желтое окрашивание. Именно по этой причине ожог азотной кислотой желтого цвета

в) Цистеиновая реакция, действует на остатки аминокислот, содержащих серу (добавляем ацетат свинца Pb(CH3COO)2)- черное окрашивание





