33 задача — вывод молекулярной и структурной формулы вещества.
За решение данной задачи ты можешь получить 3 балла.
1 балл — за правильные расчетные данные
2 балл — за установление структурной формулы
3 балл — за н6аписание химической реакции
Какие типы задач можно встретить в этом разделе?
- Определение молекулярной формулы по продуктам сгорания и далее по химическим свойствам определение структурной формулы.
- Определение молекулярной формулы по массовым долям или же общей формуле и также далее по химическим свойствам определение структурной формулы.
Таблица общих формул органических веществ:
| Класс органических веществ | Общая молекулярная формула | Формула с выделенной кратной связью и функциональной группой |
| Алканы | — | |
| Алкены | ||
| Алкины | ||
| Диены | — | |
| Гомологи бензола | ||
| Предельные одноатомные спирты | | |
| Многоатомные спирты | ||
| Предельные альдегиды | ||
| Кетоны | ||
| Фенолы | ||
| Предельные карбоновые кислоты | ||
| Сложные эфиры | ||
| Амины | ||
| Аминокислоты (предельные одноосновные) |
Основные термины, которые пригодятся для решения:
- Массовая доля элемента — содержание в веществе в процентах по его массе. Чтобы найти массовую долю, нужно разделить молярную массу вещества на массу, которая дана в задаче.
- Истинная формула — это формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
- Эмпирическая (простейшая или брутто-формула) — показывает соотношение атомов в веществе.
В случае, если в задаче даются исключительно массовые доли веществ, то в конечном итоге можно вычислить только простейшую формулу.
- Относительная плотность. Обозначается латинской буквой «D». Это величина, показывающая во сколько компонент Х тяжелее компонента У. Важно помнить, что при расчете с использованием относительной плотности мы молярную массу делим на нее.
Помним, что молярная масса воздуха равняется 29.
Перейдем к методикам решения.
- Определение формул веществ по массовым долям атомов, входящих в его состав.
Рассмотрим сразу на примере:
«Определите формулу вещества, если в нем содержится 84,21% углерода и 15,78% водорода и имеет относительную плотность по воздуху, равную 3,93.»
- Пусть масса вещества равна
г. Тогда масса
будет равна
г, а масса
г.
- Найдём количество вещества каждого атома:
моль,
моль.
- Определяем мольное соотношение атомов
и
:
(сократим оба числа на меньшее)
(домножим на 4)
Таким образом, простейшая формула
. Однако вещества с такой формулой не существует. Для нахождения молекулярной формулы нам потребуется домножать простейшую формулу на небольшие числа: 2, 3 и т. п. Например при домножении эмпирической формулы на 2 мы получаем алкан, имеющий в своём составе 8 атомов углерода:
.Чтобы проверить, правильна ли найденная нами формула, необходимо использовать дополнительные данные, которые всегда указаны в задаче. Это могут быть либо химические свойства вещества, либо информация, позволяющая вычислить его молярную массу. В данном случае дана относительная плотность соединения по воздуху.
- По относительной плотности рассчитаем молярную массу:
г/моль. Молярная масса, соответствующая простейшей формуле
г/моль, это в
раза меньше истинно молярной массы. Значит, истинная формула
.
Структурная формула полученного соединения:
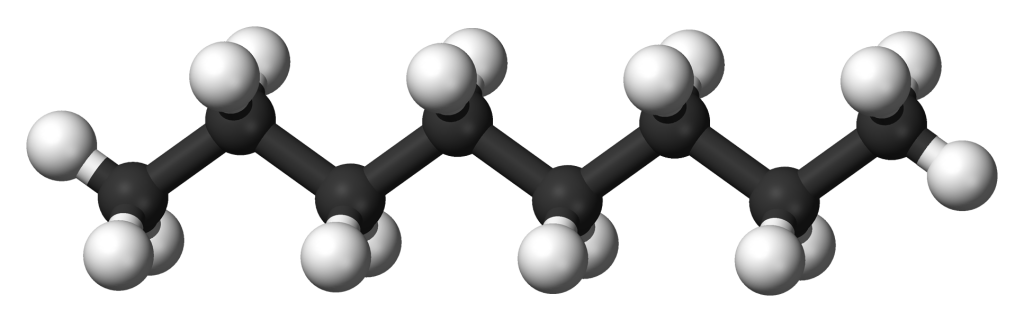
2. Определение формул веществ по продуктам сгорания.
В таком типе задач, количество вещества будем находить через объемы и массы сгораемого вещества. Данный тип не сильно отличается от предыдущего, поэтому алгоритм решения будет похожим.
«Относительная плотность паров органического соединения по азоту равна . При сжигании
г этого соединения образуется
л углекислого газа (н. у) и
г воды. Выведите молекулярную формулу органического соединения.»
- Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов
и, возможно,
. Поэтому его общую формулу можно записать как
.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
- Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
моль.
- На одну молекулу
приходится один атом
, значит, углерода столько же моль, сколько
.
моль
моль.
- В одной молекуле воды содержатся два атома
, значит количество водорода в два раза больше, чем воды.
моль.
- Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г Масса всего вещества
г.
, т.е. в данном веществе нет атомов кислорода. Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов.
- Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
- Простейшая формула
.
- Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул
и его молярная масса
г/моль):
г/моль.
- Истинная формула
, её молярная масса 14. 56/14=4
- Истинная формула
.
Структурная формула полученного соединения:

Частые ошибки при решении 33 задачи:
- Некорректное оформление задачи.
- Решение методами подборов, а не математических вычислений.
- Незнание общих формул углеводородов и расчетных формул.
- Ошибки при написании уравнений реакций.
Не все химические соединения вредны. Без водорода и кислорода, например, нельзя было бы получить воду, основной компонент пива.




